mRNA疫苗的昨天、今天与明天
mRNA(Messenger RNA,信使RNA)在人类生物学中起着基本作用,它转移存储在DNA中的指令来制备活细胞所需的蛋白质。由于RNA的稳定性较差,这使得它的治疗用途开始时并未引起人们的注意。在广泛应用体外转染技术发展之后,1989年mRNA作为治疗剂首次被推广【1】,仅在几年后,mRNA被提倡作为一种治疗药物。英国Nature杂志于2017年7月刊登一篇由Ugur Sahin教授率领的团队,开发出含有多种肿瘤新抗原的个性化mRNA疫苗在有13名黑色素瘤患者受试者中进行测试,结果8名患者肿瘤得到有效治疗且1年内未复发,肿瘤缩小者2名,1名患者在接受PD-1抗体药物后得到完全缓解,其中有5名患者在接受疫苗时肿瘤已经出现扩散,mRNA疫苗这一巨大的临床进展让全球的目光重新被聚焦在mRNA疫苗上【2】。离体mRNA转染树突状细胞首次进入临床试验,过去二十年间,基于mRNA的临床试验已经开展了数百个【3】
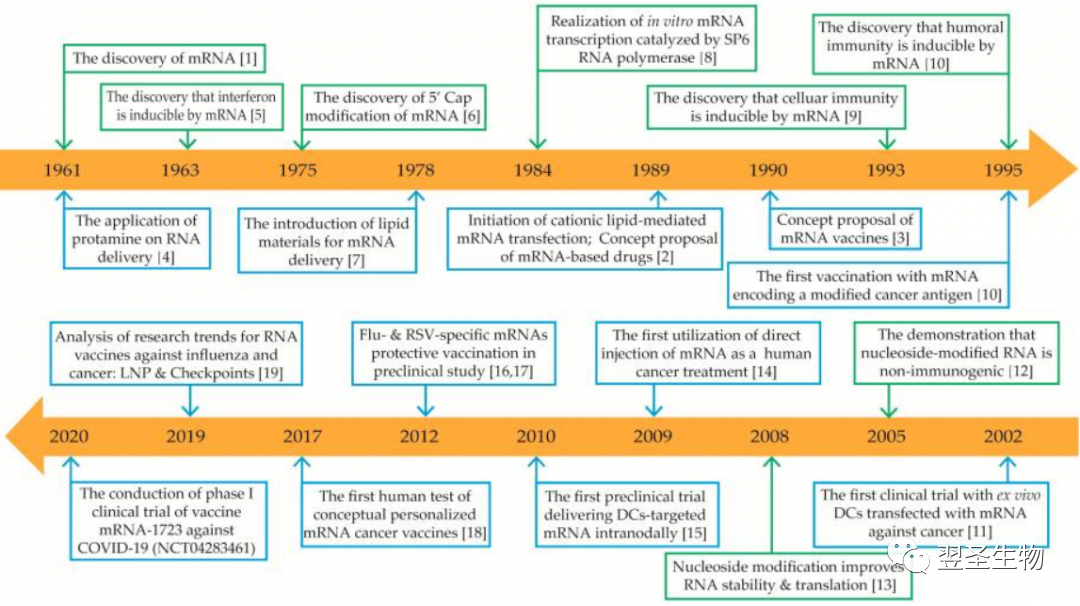
图:Timeline of some key discoveries and advances in the development of mRNA-based drug technology [4]
mRNA疫苗
mRNA疫苗是将RNA在体外进行相关的修饰后传递至机体细胞内表达并产生蛋白抗原,从而导机体产生针对该抗原的免疫应答,进而扩大机体的免疫能力【5、6】。虽然RNA不稳定,但可以通过对RNA进行修饰以增强其稳定性,研究发现,Cap结构与mRNA的稳定性密切相关,且Cap可通过与真核翻译起始复合物eIF4F结合影响mRNA翻译效率。在体内转录时传统的帽子结构分为3种即m7GpppXpYp ( Cap0 ) 、m7GpppXmpYp ( Cap1 ) 、m7GpppXmpYmp( Cap2)。由于加帽后mRNA 5'端没有游离的末端磷酸基团,所以对碱性磷酸酶很稳定。3'端Poly( A) 尾结构是除了5'端Cap 结构以外对mRNA稳定性最重要的结构。虽然mRNA的降解既可从外部结构Poly( A)尾、帽子被除去开始,也可以由内切酶从内部攻击mRNA 开始,但是大多数的mRNA降解是从Poly( A) 尾开始的【7】
完整的mRNA结构有利于mRNA的稳定性和表达能力。在体外合成的mRNA添加一些基本结构元件才能达到与真核细胞mRNA相似的效果,在其蛋白编码的开放阅读框(ORF) 5’端添加m7GPPPN结构即7-甲基鸟苷帽子结构和3’端poly(A)尾以促进mRNA的稳定性。其中5’端加帽是重要的过程,此过程常应用酶学法加帽如牛痘病毒加帽酶(Vaccinia Capping Enzyme)和poly(A) Polymerase。
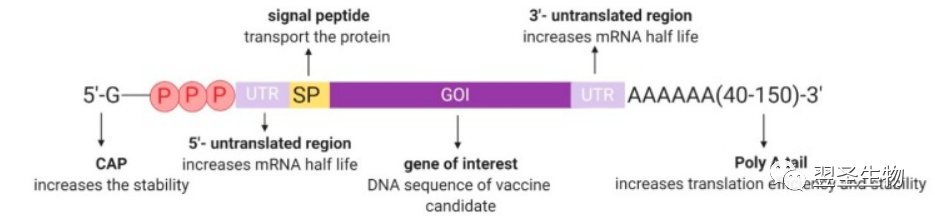
图:A typical mRNA construct with supporting untranslated regions, poly(A) tail, and an optional signal peptide sequence attached to the coding sequence[8]
mRNA疫苗的分类
mRNA疫苗分为非复制性mRNA(nonreplicating mRNA)和自扩增mRNA(self-amplifying mRNA)两类:自扩增mRNA不仅编码目标抗原,而且还编码能够使细胞内RNA扩增和蛋白表达的复制机制。非复制性mRNA疫苗仅编码目标抗原并包含5′和3′非翻译区(UTR),它们提供对适应性和先天免疫力的综合刺激,即原位抗原表达和危险信号传递,具备有以下应用特性【9、10】
●可提供对适应性和先天免疫力的综合刺激,即原位抗原表达和危险信号传递
●可以诱导“平衡”免疫反应,包括体液和细胞效应因子以及免疫记忆
●可结合不同的抗原而不会增加疫苗配制的复杂性
●可通过重复性的疫苗接种实现持续的免疫潜力提升,并且对载体没有或有很少的免疫反应
●热稳定mRNA疫苗可简化疫苗的运输和储存
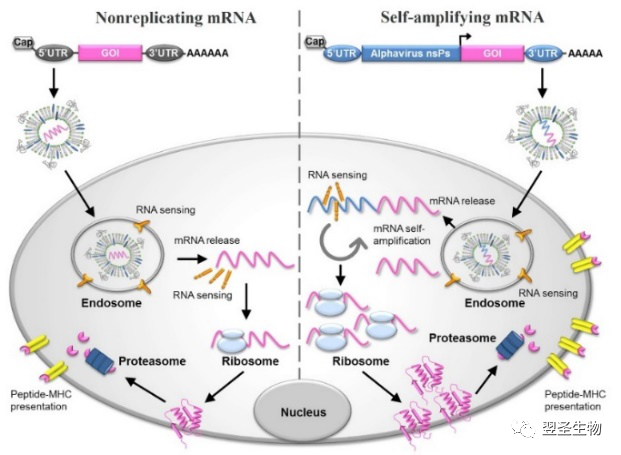
图:mRNA疫苗的示意图及其抗原表达的机制[11]
mRNA疫苗的特点
相比传统疫苗,mRNA疫苗生产工艺简单、开发速度快、无需细胞培养、成本低。相较与DNA疫苗,mRNA疫苗无需进入细胞核,没有整合至宿主基因组的风险,半衰期可以通过修饰进行调整。
表:mRNA疫苗的优缺点
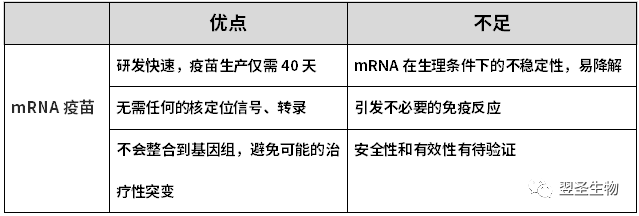
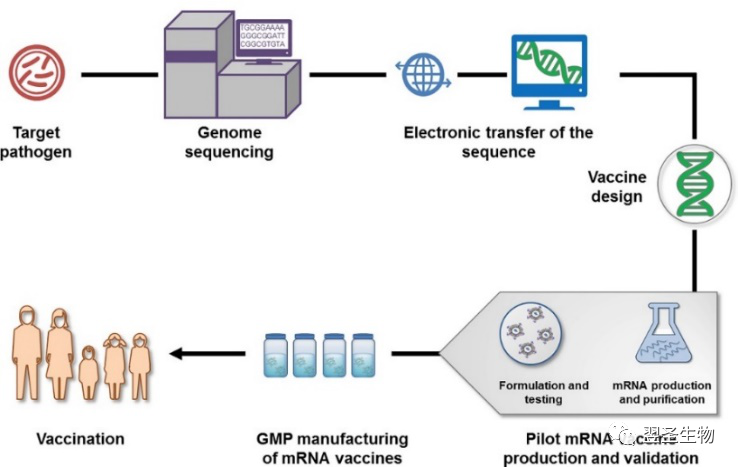
图:mRNA疫苗生产制备流程图[11]
COVID-19疫苗进展简介
2020年大规模爆发的COVID-19,至今已导致超过1亿人次的感染,超过2百万人死亡【12】,已有多家企业以mRNA为研究基础或拥有mRNA研发平台,2020年12月18日,美国食品和药物管理局(FDA)批准了美国生物科技公司Moderna研发的新 冠肺炎疫苗mRNA-1273的紧急使用授权,这是继2020年12月11日,美国食品药物管理署(FDA)批准美国辉瑞与德国生物新技术公司BioNTech的BNT162b2新 冠疫苗之后第二种在美国获准使用的疫苗。这两个最快上市的疫苗均采用了第三代mRNA疫苗技术平台,第三期人体临床试验有效率高达95%,这足以显示mRNA疫苗技术的快速、高效的特点,其他公司相关COVID-19疫苗的开发信息如下表所示。
表:COVID-19相关mRNA疫苗临床进展概况
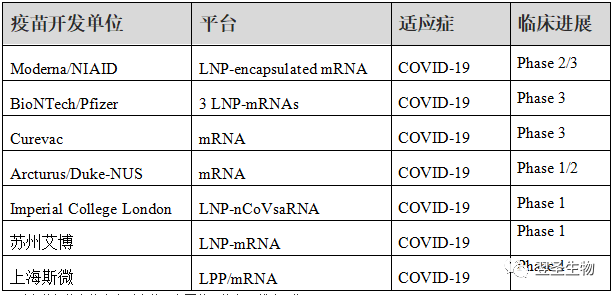
注:以上数据信息均来自对应公司官网公开信息(截止日期:20210131)
mRNA疫苗疗法的发展方向
由于mRNA疫苗生产工艺简单、开发速度快、疫苗免疫效能高等特点,基于mRNA有望成为治疗遗传病、癌症、传染病及其他疾病的有效疗法。越来越多的生物技术公司涉足该领域,例如Moderna,CureVac,BioNTech等。
表:Moderna招募mRNA疫苗的临床试验
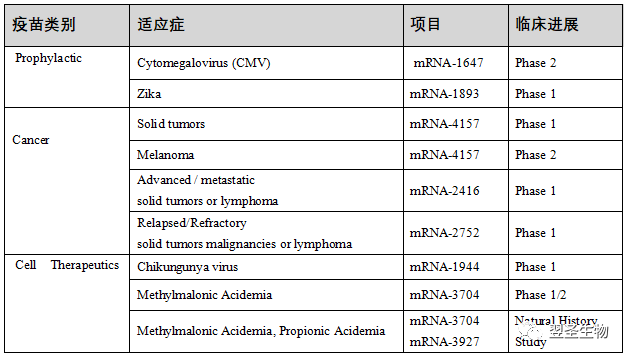
注:以上数据信息均来自Moderna公司官网公开信息(截止日期:20210131)
随着COVID-19 mRNA疫苗在多国的大规模应用,越来越多的资本进入以及新技术发展,大大加速了mRNA疫苗领域的快速发展,未来将有宽广的发展空间。例如新的mRNA 疫苗的设计、mRNA传递技术的发展均可以影响到靶蛋白的表达及mRNA与模式识别受体的相互作用。直接将mRNA传递至细胞质可以增强靶蛋白的表达,避免与模式识别受体的结合也可大大减弱mRNA传递本身带来的免疫刺激。新的方法来增强mRNA靶向特异性的细胞类型也成为mRNA疫苗潜在的突破方向【13】。
但关于mRNA技术的发展,也存在一定的难点亟待解决,如mRNA的递送、脱靶和免疫原性这些关键问题,依然有部分关键问题需要解决,根据辉瑞和BioNTech合作开发的mRNA疫苗三期临床试验,疫苗的有效率为94.6%。结果显示,常见的副作用有注射部位反应 (84%)、疲倦(63%)、头疼 (55%)等,这些都是打疫苗常见的副作用。第二针后反应更大,55岁以下的人反应也更大。就目前看来,mRNA疫苗比流感疫苗的副作用要大一些,相应文章数据也显示,疫苗组约有0.6%的人产生了过敏类的反应,但0.5%盐水组的人也有这种反应。【14】
注释
【1】Malone RW, Felgner PL, Verma IM. Cationic liposome-mediated RNA transfection. Proc Natl Acad Sci U S A. 1989;86:6077–81.
【2】胡瞬,易有金,胡涛,李福胜. mRNA疫苗的开发及临床研究进展[J]. 中国生物工程杂志,2019,11:105-112.
【3】Yuhua Weng, Chunhui Li, Tongren Yang,et,al.The challenge and prospect of mRNA therapeutics landscape.Biotechnology Advances.Volume 40, May–June 2020, 107534。
【4】Verbeke, Rein & Lentacker, Ine & De Smedt, Stefaan & Dewitte, Heleen. (2019). Three decades of messenger RNA vaccine development. Nano Today. 100766. 10.1016/j.nantod.2019.100766.
【5】苗鹤凡, 郭勇, 江新香. mRNA疫苗研究进展及挑战[J]. 免疫学杂志, 2016(05):446-449.
【6】Kramps T., Elbers K. (2017) Introduction to RNA Vaccines. In: Kramps T., Elbers K. (eds) RNA Vaccines. Methods in Molecular Biology, vol 1499. Humana Press, New York, NY.
【7】Zika virus protection by a single low-dose nucleoside-modified mRNA vaccination[J]. Nature, 2017, 543(7644):248-251.
【8】Versteeg L, Almutairi MM, Hotez PJ, Pollet J. Enlisting the mRNA Vaccine Platform to Combat Parasitic Infections. Vaccines (Basel). 2019;7(4):122.
【9】Pardi N , Hogan M J , Porter F W , et al. mRNA vaccines — a new era in vaccinology[J]. Nature Reviews Drug Discovery, 2018.
【10】Kramps T., Elbers K. (2017) Introduction to RNA Vaccines. In: Kramps T., Elbers K. (eds) RNA Vaccines. Methods in Molecular Biology, vol 1499. Humana Press, New York, NY
【11】Maruggi G , Zhang C , Li J , et al. mRNA as a Transformative Technology for Vaccine Development to Control Infectious Diseases[J]. Molecular Therapy, 2019.
【12】https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports/
【13】Zhang, F., Parayath, N.N., Ene, C.I. et al. Genetic programming of macrophages to perform anti-tumor functions using targeted mRNA nanocarriers. Nat Commun 10, 3974 (2019).
【14】Polack FP, Thomas SJ, Kitchin N, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 31;383(27):2603-2615. doi: 10.1056/NEJMoa2034577. Epub 2020 Dec 10. PMID: 33301246; PMCID: PMC7745181.
HB210209
