干货分享|排除万难,成为核酸电泳小达人,跑出一手好胶!
下面小翌根据多年的售后经验,精心为您整理了核酸电泳的常见问题与解决方案。助您轻轻松松做实验,大把时间写文章~
1. 无条带
1) DNA条带跑出凝胶,减少电泳时间。
解决办法:电泳时,注意观察溴酚蓝跑到凝胶的2/3处即可停止电泳。缩短电泳时间或降低电压或增强凝胶浓度。
2) 染料的激发波长使用错误,选用适合的激发波长。
例如:核酸染料YeaRed(Cat NO.10202ES, Yeasen)最大激发波长是300 nm左右,需用紫外成像仪检测。YeaRed在可见光下激发(如蓝光成像仪)很弱,会导致没有条带或条带非常弱。
解决办法:改用紫外激发检测。
3) 凝胶中未加入染料或染料失效,更换新的染料,重新实验。
解决办法:换一支新的染料进行对比实验,确认是否为核酸染料导致。
2. 条带弱
1) 染料和核酸结合不充分导致大分子条带弱,增加染料浓度或减少核酸上样量。
可能原因:染料和核酸结合不充分导致大分子条带弱。小分子条带因核酸量小,很容易与核酸染料结合达到饱和状态,而大分子条带与核酸染料结合未饱和,从而导致条带弱些。
解决办法:适量增加胶中核酸染料浓度或适当减少核酸上样量,以保证核酸染料与核酸结合充分。
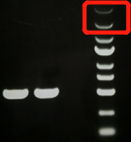
图1. 大分子条带弱
2) 染料迁移影响小分子条带弱,提高Marker上样量。
可能原因:染料迁移导致小分子条带弱。例如,在染料饱和的情况下,由于核酸染料EB带正电荷,核酸分子带负电荷,二者在电场中的迁移方向相反,而小分子DNA跑在最前面,相对结合的染料更少些,所以条带弱一些。
解决办法:属正常现象,无需优化。若想优化,可适当提高Marker上样量,选择大小合适的Marker,调整电泳时间;或者可改为泡染法,泡染法不会受染料迁移的影响。

图2. 小分子条带弱
3) 样品上样量不够,梯度提高样品上样量。
可能原因:样品或Marker上样量不够。
解决办法:根据说明书要求进行加样,或者根据实验调整加样量。
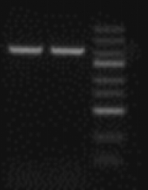
图3. 上样量不足导致条带弱
4) 样品部分降解,重新更换新样品实验。
a) 可能原因:核酸酶污染导致样本降解。
解决办法:不使用含有核酸酶的试剂和耗材,避免核酸酶污染。
b) 可能原因:泡染法染色时间过长。
解决办法:一般泡染法根据说明书推荐时间进行染色。
c) 可能原因:拍照前放置过久。
解决办法:电泳后及时观察、拍照。
d) 可能原因:Marker由于保存不当降解。
解决办法:按照说明书推荐的保存方式进行保存。
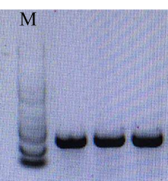
图4. Marker降解
3. 条带弥散
1) 琼脂糖溶解不充分、胶未完全凝固,需充分溶解琼脂糖,延长凝胶时间。
可能原因:琼脂糖溶解不充分,凝胶时间过短、胶未完全凝固,胶孔大小不均匀,导致核酸电泳速度不均匀,出现抹带现象。
解决办法:确认胶彻底溶解后溶液透明清亮,无油状。一般100 mL的1%琼脂糖凝胶的凝胶时间为30-40 min。
【注】溶胶过程需避免水分蒸发,可通过重新定容进行确认。
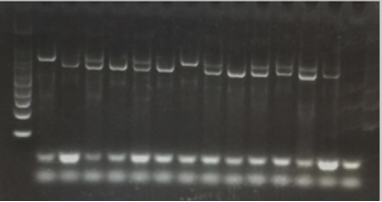
图5. 琼脂糖溶解不充分导致的条带弥散
2) 染料不均匀,配胶时需摇匀。
可能原因:核酸染料迁移的影响。因市面上的无毒核酸染料多为大分子结构,若不均匀,容易使得同样大小的DNA片段结合的核酸染料量不一样,迁移的速度就会受到影响,从而形成抹带。
解决办法:加入核酸染料后充分摇匀或者改用泡染法。
【注】若怀疑问题与核酸染料影响核酸迁移有关,可使用泡染法染色以确认问题是否与染料有关。如果染色后问题依旧存在,可判断问题与染料无关。可尝试优化其它条件。
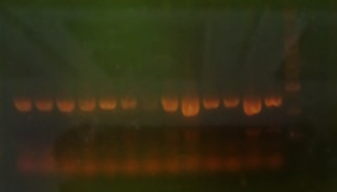
图6. 核酸染料不均匀导致的条带弥散
3) 电压过小,增加电压至110-130V。
可能原因:电压过小,使DNA条带发生扩散。
解决办法:建议电压为5-10V/cm,一般是110-130V,最高不超过150V。
4) 缓冲溶液使用次数过多,建议一次性使用。
可能原因:离子强度降低,PH值上升,缓冲能力减弱,从而影响电泳结果。
解决办法:经常更换电泳缓冲液。
5) 上样量过多,减少上样量。
可能原因:上样量过多会造成加样孔超载,导致拖尾或者弥散。
解决办法:一般情况下,5 mm宽的梳子可以加入0.5 µg的核酸,加样量根据加样孔的大小和核酸大小而定。因此根据琼脂糖胶孔大小适当的调整核酸的上样量。
6) 样品部分降解。
可能原因与解决办法参考“条带弱”中样品降解情况。
7) 琼脂糖凝胶浓度不合适,根据分子量大小选择合适胶浓度。
推荐参照琼脂糖凝胶浓度对照表1:
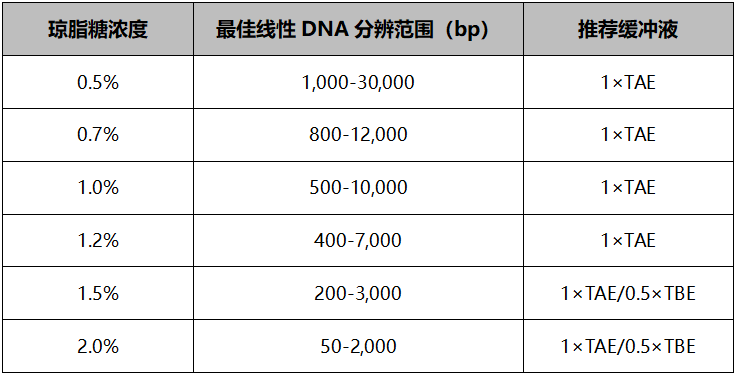
整体原则是大片段选择低浓度凝胶,用TAE缓冲电泳体系;小片段选择高浓度凝胶,用TBE缓冲电泳体系。
4. 条带弯曲或弧形
1) 电压过大,推荐<150V,最好110-130V。
可能原因:电压过大,易导致条带弯曲拖尾现象。
解决办法:降低电泳电压,建议电压为5-10 V/cm,一般是110-130 V,最高不超过150 V。
2) 上样量过高,梯度降低样品上样量。
可能原因:核酸分子上样量过高,导致核酸与染料结合不充分,易导致条带弯曲现象。
解决办法:减少核酸上样量,对于未知浓度的样品,尝试1/2或1/3的常用上样量。对于Marker样本,稀释后效果更好。
以图7中的Marker为例,左图Marker上样量:原液5 µL,大分子条带弯曲、拖尾且分不开。右图:将Marker原液2 µL稀释5倍加10 µL,条带清晰不拖尾。
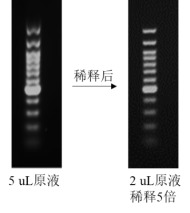
图7. 左:大分子条带弯曲拖尾分不开,右:条带分离清晰(Marker: 100 bp ladder)
3) 染料量不足,一般使用1×工作浓度。
可能原因:核酸染料量不足,导致核酸与染料结合不充分,易导致条带弯曲现象。
解决办法:一般根据说明书推荐的核酸染料1×终浓度进行实验,或适当提高核酸染料使用的终浓度。
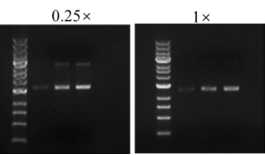
图8. 左:弯曲拖尾分不开(YeaRed核酸染料终浓度0.25×),右:大分子条带分离清晰(YeaRed核酸染料终浓度:1×)
5. 样品条带与Marker之间指示大小不一致
1) 核酸染料不充足,一般使用1×工作浓度。
可能原因:核酸染料不充足,会发生迁移率误差情况。
解决办法:建议提高核酸染料的工作浓度.
2) 上样量差异影响,建议样品与Marker的上样体积相近。
可能原因:Marker与样本的上样量差异,会引起较大迁移误差。
解决办法:样品与Marker的上样体积相近,更容易跑出理想的电泳结果。
6. Marker缺带
1) 小分子条带跑出凝胶导致缺带,减少电泳时间。
解决办法:适当缩短电泳时间,降低电压,或增加凝胶浓度。
2) 相近的大分子条带分不开导致缺带,提升染料浓度或减少Marker上样量。
可能原因:Marker浓度比较高, 导致核酸与染料结合不充分。
解决办法:稀释后使用(参考图7)。具体情况,根据Marker说明书进行操作。
好了,小翌今天的分享到这里就结束了~
祝大家实验顺利!加油!科研人~
等等!
这里还有一个小秘密,一般核酸电泳以Marker为分子标记,如果以上内容不能够解决大家的核酸电泳问题,有可能是你的核酸染料与Marker不兼容呢!可以尝试更换相应产品,判断、解决问题~
小翌这里推荐大家购买Yeasen安全无毒核酸染料(Cat NO.10202ES)与相应的Marker搭配使用更香哦!
相关产品
|
产品名称 |
产品货号 |
规格 |
|
10202ES76 |
500 μL |
|
|
10501ES60/80 |
100/1000 T |
|
|
10504ES60/80 |
100 /10×100 T |
|
|
10507ES60/80 |
100 /10×100 T |
|
|
10510ES60/80 |
100 /10×100 T |
|
|
10208ES60/76 |
100/500 g |
HB201127
