mRNA体外合成整体解决方案
随着生物科技的发展,生物治疗业已成为重要的前沿疾病治疗技术,其中利用RNA体外合成技术制备的mRNA疫苗在2020年大爆发的COVID-19传染病上产生了巨大的影响。很多公司如美国Moderna、德国CureVac、BioNTech等均已经开展了其他疾病如肿瘤、传染病、慢性病等治疗性mRNA疫苗和药物开发。
mRNA疫苗
mRNA(Messenger RNA或信使RNA)在人类生物学中起着基本作用,它转移存储在DNA中的指令来制活细胞所需的蛋白质。mRNA疫苗是将RNA在体外进行相关的修饰后传递至机体细胞内表达并产生蛋白抗原,从而导机体产生针对该抗原的免疫应答,进而扩大机体的免疫能力[2,3]。mRNA疫苗分为非复制性mRNA(nonreplicating mRNA)和自扩增mRNA(self-amplifying mRNA)两类:自扩增mRNA不仅编码目标抗原,而且还编码能够使细胞内RNA扩增和蛋白表达的复制机制。非复制性mRNA疫苗仅编码目标抗原并包含5′和3′非翻译区(UTR),它们提供对适应性和先天免疫力的综合刺激,即原位抗原表达和危险信号传递。
mRNA疫苗开发流程包括病原体识别、测序、mRNA体外合成和修饰、纯化等操作。
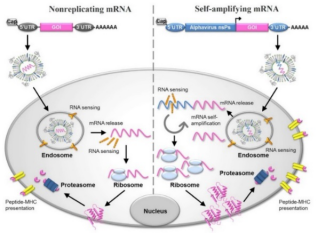
图1. mRNA疫苗的示意图及其抗原表达的机制[4]
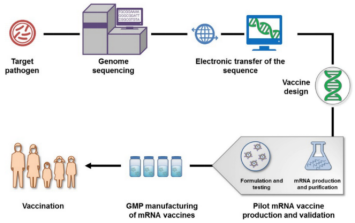
图2. mRNA疫苗生产制备流程图[5]
在mRNA疫苗和基因治疗等领域中,高效合成高质量的mRNA是实现疗法目标的关键步骤。而在这一过程中,T7 RNA聚合酶扮演着至关重要的角色,它能够高效地催化体外合成mRNA的过程。
尽管T7 RNA聚合酶在mRNA合成中发挥着重要作用,但实际操作中经常会产生双链RNA(dsRNA)这一副产物。dsRNA的存在不仅降低了mRNA的产量和纯度,还可能激发非特异性免疫反应,影响疗效和安全性。因此,减少dsRNA的产生成为了行业的一个迫切需求。
翌圣生物利用其ZymeEditor定向进化平台的能力,持续在进化mRNA体外合成的核心酶原料—T7 RNA聚合酶,开发出一款低dsRNA T7 RNA 聚合酶,可大幅度降低dsRNA,
» 产品特点
- 产量:均稳定在9mg/mL
- dsRNA含量:野生型T7 RNAP的dsRNA的含量显著降低了10倍以上
- 片段加帽率高:均超过99%
»产品数据
- 在不同长度的应用场景下,dsRNA无论跟WT T7 ,还是竞品,在保证其他指标不降的前提下,dsRNA 均有大幅度下降。
|
片段长度 |
T7 RNA pol |
产量(mg/mL) |
完整度(%) |
dsRNA含量((1ug RNA产生 ng的dsRNA) |
|
4K |
T7-WT |
12.4 |
88.3 |
0.4273 |
|
T7-低dsRNA |
12.1 |
89.9 |
0.0129 |
|
|
竞品 |
11.0 |
87.8 |
0.0323 |
|
|
9K |
T7-WT |
9.5 |
81.9 |
2.9180 |
|
T7-低dsRNA |
9.0 |
82.0 |
0.0379 |
|
|
竞品 |
7.2 |
78.7 |
0.1805 |
2、降低Cap analog的投入量,在不同的片段长度,以及与WT的对比下,投入量降低到2.5mM, 仍能得到优异的加帽率。同时在细胞层面上,也能得到优异的表现。
|
Cap analog投入量(mM) |
加帽率(%)-4K |
1K |
|
|
WT |
mutant |
WT |
|
|
10 |
100 |
100 |
100 |
|
5 |
100 |
100 |
100 |
|
2.5 |
100 |
100 |
99.7 |

» 相关产品
|
产品名称 |
货号 |
规格 |
|
10628ES10/60/72 |
10KU/100KU/250KU |
![]()
mRNA体外合成
体外合成RNA(IVT)主要是以DNA为模板通过体外转录得到,常用的是以线性化质粒DNA或PCR扩增产物为模板利用RNA聚合酶在体外转录合成。主要过程是利用含有T7启动子(TAATACGACTCACTATAGGG)或SP6启动子(ATTTAGGTGACACTATAG)序列的DNA为模板在含有T7或SP6 RNA聚合酶的条件下,以NTP为底物合成与模板DNA中一条链互补的mRNA,简单快速获得大量的mRNA分子,通过在5’端加上帽子结构和3’端加ployA尾加强mRNA的稳定性。
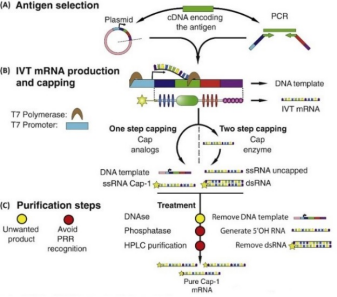
图3. 体外转录(IVT)mRNA生产和装配过程[6]
翌圣生物经过匠心研发开发出的Hifair® T7 High Yield RNA Synthesis Kit高产量体外合成试剂盒包含一整套的RNA合成所需试剂,并配有详细的教程。试剂盒可以合成长转录本以及短转录本,以1μg的模板投入量可以产生100-200 μg的RNA,适用于单链 RNA合成(包括siRNA等各类RNA前体及RNA探针)和以Cap analog为引物合成Capped mRNA。
» 产品特点
高产量:2h内产生100-200µg,单次放大反应可产生毫克级RNA
多功能: 适用于长片段和短片段RNA转录
灵活性: 可获得无标记、标记以及加帽的RNA
» 测试数据

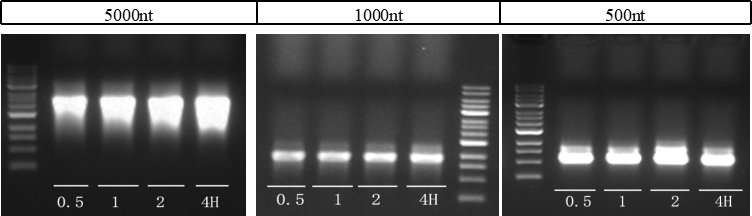
图4. 不同长度转录-时间梯度电泳图
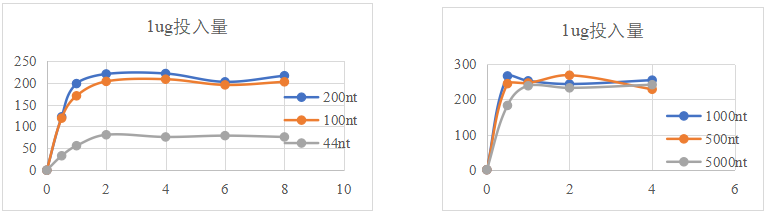
图5. 不同目的片段的转录产量
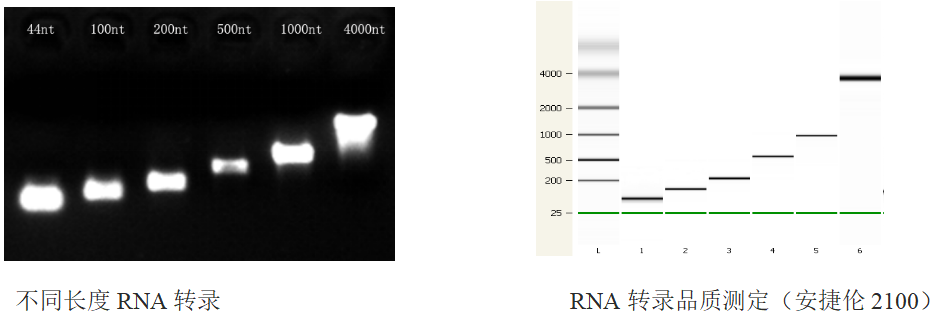
图6. 不同目的片段的转录产物品质
» 相关产品
|
产品名称 |
货号 |
规格 |
|
10623ES50/60 |
50/100T |
mRNA修饰
由于RNA的稳定性较弱,因此合成后的mRNA稳定性是必须要重点关注的问题。通常需要通过在5’端加上帽子结构和3’端加ployA尾加强mRNA的稳定性。翌圣提供低残留和高效加帽的Vaccinia Capping Enzyme(牛痘病毒加帽酶)是经过GMP生产获得,完全满足疫苗生产所需,并提供其他相关的酶类和试剂。
» 产品特点
生产工艺:GMP工艺生产
残留:无核酸酶、内毒素含量低
来源:大肠杆菌重组表达
纯度高:纯度 >95%(SDS-PAGE)
比活:~160000U/mg(BCA)
» GMP级别质检
|
质检项目 |
蛋白酶 |
核酸外切酶 |
切口酶 |
RNA酶 |
内毒素 |
宿主蛋白 |
宿主核酸 |
无菌检测 |
病原体 |
支原体 |
… |
|
√ |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
注:具体质检标准及数据参考具体COA,病原体包括HBC/HCV/HIV,其他产品病原体检测均是。
» 加帽效率
质谱测定两种酶的加帽效率,并与对照品的酶加帽效率进行对比,可以发现翌圣的加帽效率比较高,获得的产物的纯度也较高。
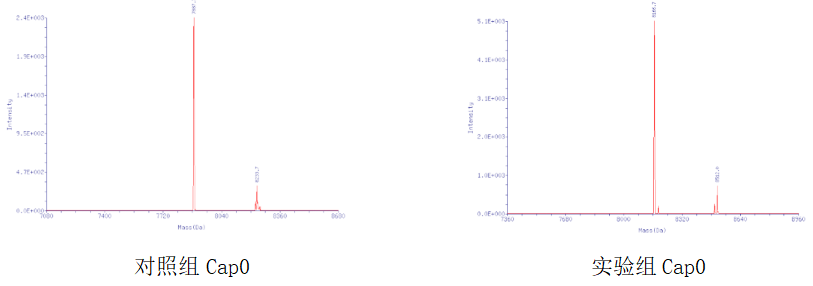
» 残留检测
分别检测Rnase、核酸酶、切口酶、大肠杆菌DNA残留,经检测结果显示,成品无相关酶的残留,且表达的宿主DNA残留也达到了要求标准。
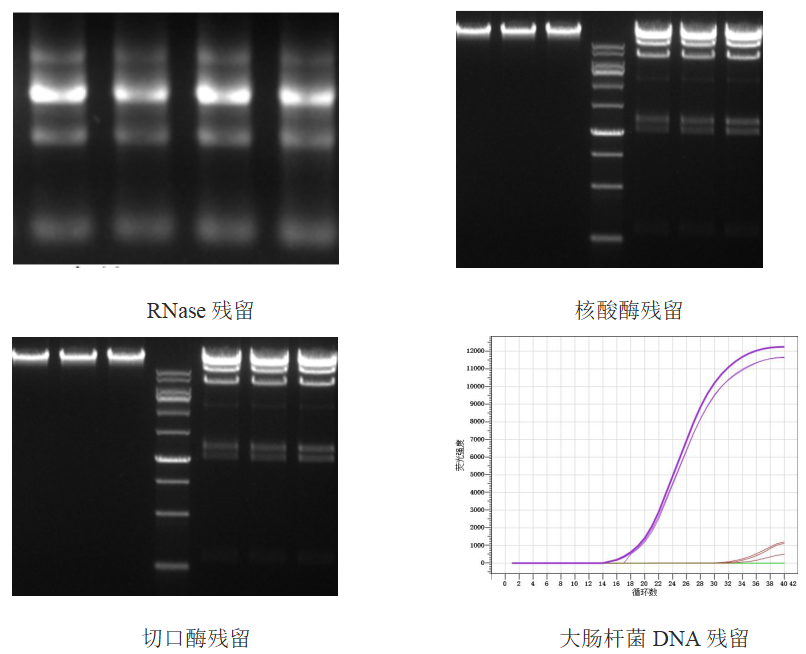
» 相关产品
|
产品名称 |
货号 |
规格 |
|
10614ES84/92/94 |
2000/10000/20000U |
mRNA残留去除
合成后的产物可能会有DNA残留,在疫苗开发阶段,残留的去除是关键的步骤,以减少下游纯化难度并增加产品的纯度。翌圣生物开发的DNase I是通过原核生物表达并经过GMP工艺生产,满足疫苗开发的需求。
» 产品特点
生产工艺:GMP工艺生产
残留:无核酸酶、内毒素含量低
来源:大肠杆菌重组表达
纯度高:≥80% by Biuret
酶活:≥2000 Kunitz Units/mg protein
» GMP级别质检
|
质检项目 |
蛋白酶 |
核酸外切酶 |
切口酶 |
RNA酶 |
内毒素 |
宿主蛋白 |
宿主核酸 |
无菌检测 |
病原体 |
支原体 |
… |
|
√ |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
注:具体质检标准及数据参考具体COA
» 测试数据
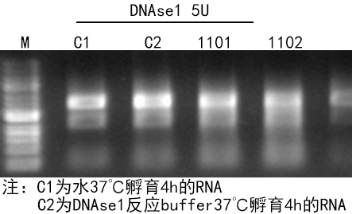
图7. RNAse残留检测
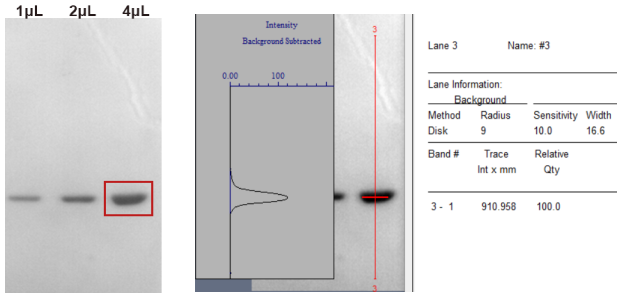
通过SDS-PAGE分析确定的DNase I(无RNase)纯度约为95%。
图8. DNase I(无RNase)纯度检测(SDS-PAGE)
» 相关产品
|
产品名称 |
货号 |
规格 |
|
10611ES76/84 |
500/2000U |
mRNA纯化
在经历严格的合成及修饰后,所获得的mRNA需要进一步的纯化以达到后续研究的纯度标准。翌圣生物开发的mRNA纯化磁珠是偶联了Oligo(dT)的微米级顺磁性微球。运用Oligo(dT)特异结合到mRNA上Poly(A)尾端,特异地将mRNA从总RNA中分离出来。
» 产品特点
高效率:mRNA纯化在45min内完成
高纯度:Oligo(dT) 磁珠特异性吸附mRNA
灵活:兼容手动和自动化操作平台
可靠:获得的mRNA适用NGS、体外翻译、RT-PCR和CDNA合成
» 纯化效果好
使用磁珠纯化拟南芥和小鼠肝组织RNA样本,Hieff NGS® mRNA Isoaltion Beads的mRNA回收效率更高,rRNA的去除效果更好。
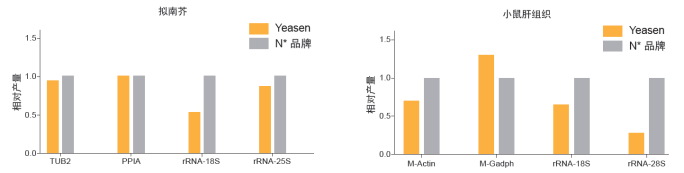
图9. mRNA Isolation Kit纯化不同RNA样本中的mRNA 管家基因产量表征mRNA回收效果。rRNA相关基因产量表征rRNA去除效果
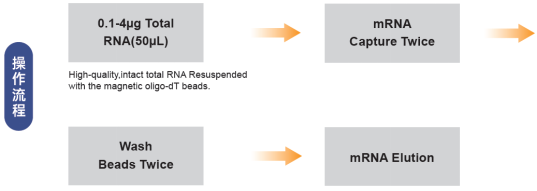
图10. mRNA 纯化操作流程
» 相关产品
|
产品名称 |
货号 |
规格 |
|
12603ES24 /96 |
24/96T |
翌圣生物作为分子酶领域创新领导者,专注为您提供高品质的分子酶产品及相关试剂盒,为您的科学研究和药物及疫苗的开发提供更多选择和方便,也为人类的未来健康事业奉献一份力量。
其他相关产品
|
产品名称 |
货号 |
规格 |
|
10625ES10/60/86 |
10/100/2500KU |
|
|
10628ES10/60/72 |
10/100/250KU |
|
|
10621ES10/20/60 |
10/20/100KU |
|
|
10620ES10/60/80 |
10/100U/1000U |
|
|
10623ES50/60/70 |
50/100/500T |
|
|
10614ES84/92/96 |
2/10/100KU |
|
|
10612ES92/97/98 |
10000/50000/250000U |
|
|
10619ES02/25/50 |
0.5/25/50mL |
|
|
10611ES76/84/92 |
500/2000/10000U |
|
|
10655ES03/10/60 |
1/10/100mL |
【1】Verbeke, Rein & Lentacker, Ine & De Smedt, Stefaan & Dewitte, Heleen. (2019). Three decades of messenger RNA vaccine development. Nano Today. 100766. 10.1016/j.nantod.2019.100766.
【2】苗鹤凡, 郭勇, 江新香. mRNA疫苗研究进展及挑战[J]. 免疫学杂志, 2016(05):446-449.
【3】Kramps T., Elbers K. (2017) Introduction to RNA Vaccines. In: Kramps T., Elbers K. (eds) RNA Vaccines. Methods in Molecular Biology, vol 1499. Humana Press, New York, NY.
【4】Verbeke, Rein & Lentacker, Ine & De Smedt, Stefaan & Dewitte, Heleen. (2019). Three decades of messenger RNA vaccine development. Nano Today. 100766. 10.1016/j.nantod.2019.100766.
【5】Sergio Linares-Fernández, Céline Lacroix, ,Tailoring mRNA Vaccine to Balance Innate/Adaptive Immune Response,Trends in Molecular Medicine,Volume 26, Issue 3,2020,Pages 311-323,
【6】Sergio Linares-Fernández, Céline Lacroix, ,Tailoring mRNA Vaccine to Balance Innate/Adaptive Immune Response,Trends in Molecular Medicine,Volume 26, Issue 3,2020,Pages 311-323,
HB201226
