Nuclease非限制性核酸内切酶-核酸消除的“终极武器”
——核酸消除的“终极武器”

翌圣生物研发团队利用一流的基因工程改造技术,研制而成的核酸去除的“终极武器”—非限制性核酸内切酶,既保证了产品的纯度与酶活,又确保了产品的稳定性,目标客户攘括工业端与科研端两大科学研究链,可满足广大生物研究者的基本需求。
翌圣核酸酶,严格把控,品质优先
1、质检项目
|
货号 |
表达宿主 |
活性 |
内毒素去除 |
浓度 |
纯度SDS-PAGE |
纯度SEC-HPLC |
细菌检测 |
蛋白酶检测 |
|
翌圣20125(工业) |
酵母菌 |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
|
翌圣20156(科研) |
大肠杆菌 |
√ |
√ |
√ |
||||
|
翌圣20157(工业) |
大肠杆菌 |
√ |
√ |
√ |
√ |
√ |
√ |
√ |
2、质检结果
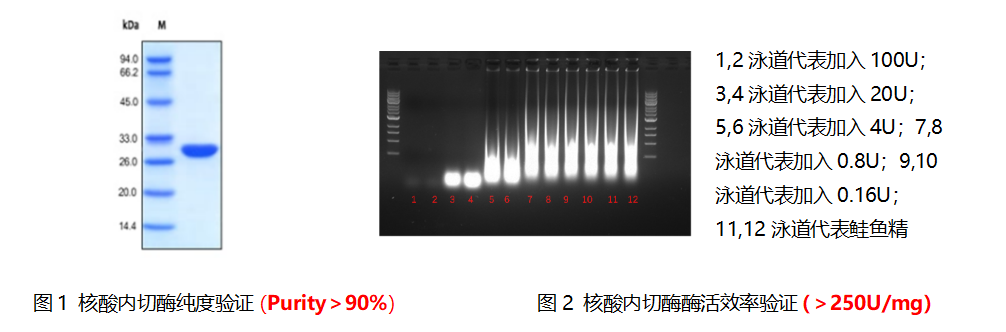
核酸内切酶超强特性
特性一:耐受性强
能够与多种细胞裂解液同时使用,如RIPA;与含有多种离子和非离子型去污剂、还原剂的蛋白提取试剂等兼容。
|
试剂 |
耐受剂量 |
耐受程度 |
|
盐酸胍 |
>100 mM |
完全抑制Benzonase活性 |
|
EDTA |
1 mM |
部分抑制Benzonase活性 |
|
5 mM |
活性丧失90% |
|
|
PMSF |
1 mM |
不会抑制Benzonase活性 |
|
Triton® X-100 |
浓度<0.4% |
保持70%的活性 |
|
浓度<0.4%<1% |
活性急剧降低 |
|
|
浓度>1% |
活性丧失70% |
|
|
SDS |
浓度在0.1%~1% |
活性急剧降低 |
|
尿素 |
>6 M |
活性急剧降低 |
特性二:核酸内切酶操作简易,轻松使用
1、推荐使用条件
|
条件参数 |
最佳条件 |
有效条件 |
|
Mg2+ |
1-2 mM |
1-10 mM |
|
pH |
8-9 |
6-10 |
|
温度 |
37℃ |
0-42℃ |
|
DTT |
0-100 mM |
>0 mM |
|
巯基乙醇 |
0-100 mM |
>0 mM |
|
单价阳离子 |
0-20 mM |
0-150 mM |
|
磷酸根离子 |
0-10 mM |
0-100 mM |
2、推荐使用量
|
实验类型 |
蛋白电泳样品 |
药物生产-1g |
疫苗、病毒生产-1L |
细胞培养-1L |
|
推荐产品 |
Nuclease(科研级,20156) |
Nuclease(无内毒素级,20125,20157) |
||
|
最低要求 |
125 U(0.5 µL) |
25 U/mL(1 µL) |
0.1 U/mL(0.4 µL) |
0.1 U/mL(0.4 µL) |
|
建议用量 |
500 U(2 µL) |
250 U/mL(10 µL) |
25 U/mL(100 µL) |
5 U/mL(20 µL) |
|
孵育时间 |
通常作用时间37℃在15~60 min;25℃在30~120 min; |
|||
|
注:以上仅仅是推荐,可根据实验自主摸索最优实验条件。 |
||||
助阵四方,应用甚广
应用1,除去生物制品中的DNA/RNA
核酸内切酶可用于疫苗、多糖、蛋白等工业生物制品中核酸的去除,使生物制品的最终核酸含量符合要求,同时提高生物制品功效。并且研究者还提供了一种可获得HIV测序文库的方案HIV-SMART,其中核酸内切酶的运用,可显著提高HIV病毒测序覆盖度,且不影响病毒核酸的回收率。
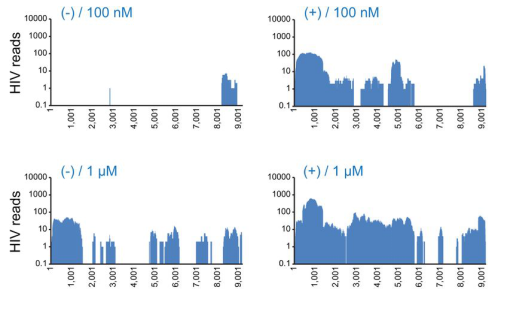
图3 (+)添加和(-)不添加核酸内切酶处理的CHU1756NGS覆盖图[1]
应用2,用于降低细胞破碎后的粘度
核酸内切酶可以降解所有形式的核酸,降低细胞裂解液的粘度,提高蛋白得率,改善分离效果,使之易于过滤(尤其是超滤),利于下游层析纯化操作。
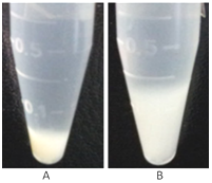
图4 细胞裂解液Nuclease处理(A)和未处理(B)比较图
应用3,生化分析样品的制备
在ELISA、色谱分析、双相电泳和足迹分析等过程中,用核酸内切酶处理含有核酸的蛋白样品,可提高分辨率,并提高回收率。
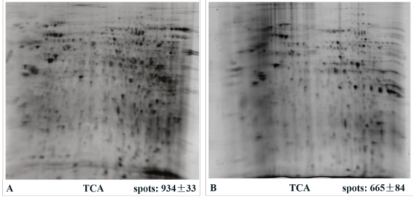
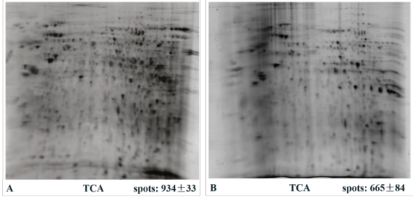
图5 小鼠脑核蛋白Nuclease处理(A)和未处理(B)双向电泳比较图[2]
应用4,CAR-T治疗相关行业(慢病毒包装)
FAQ——如何摆脱后续核酸内切酶干扰?
措施1:采用高于1mM EDTA螯合金属离子会可逆地抑制全能核酸酶活性,极端条件会造成不可逆失活,例如100 mM NaOH,70℃处理30 min等;
措施2:对于带某种标签的Nuclease核酸内切酶可通过相应的标签蛋白纯化树脂直接去除,去除率>95%;
措施3:对于不带标签的Nuclease核酸内切酶,可通过色谱纯化去除核酸内切酶,然后可通过检测残留活性或ELISA检测来判断去除是否成功。
产品订购信息
|
产品 |
货号 |
规格 |
价格(元) |
|
20125ES25 |
25 KU |
1125.00 |
|
|
20125ES50 |
50 KU |
1965.00 |
|
|
20125ES60 |
100 KU |
3245.00 |
|
|
|
20156ES25 |
25 KU |
418.00 |
|
20156ES50 |
50 KU |
768.00 |
|
|
20156ES60 |
100 KU |
1398.00 |
|
|
20157ES25 |
25 KU |
1125.00 |
|
|
20157ES50 |
50 KU |
1965.00 |
|
|
20157ES60 |
100 KU |
3245.00 |
文献引用
[1] Berg M G, Yamaguchi J, Alessandri-Gradt E, et al. A pan-HIV strategy for complete genome sequencing[J]. Journal of clinical microbiology, 2016, 54(4): 868-882.
[2] Jankowska U, Latosinska A, Skupien-Rabian B, et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain[J]. Journal of neuroscience methods, 2016, 261: 1-9.
HB201214
