干货分享|转染效率低?小翌手把手教你做细胞转染实验
转染效率是判断细胞转染成功的重要指标之一,受到诸多因素的影响,如核酸纯度、细胞密度、生长状态等等,本期为大家带来完整的细胞转染原理与操作与问题的解决方案。
细胞膜是由磷脂双分子层和镶嵌蛋白组成的,带有负电荷。因此带有负电荷的DNA或RNA无法通过细胞膜。为了让核酸(DNA或RNA)通过细胞膜,研究人员利用不同的方法,包括使用化学物质和包被核酸的载体分子进行中和,以及在细胞膜上开孔等物理方法,将核酸(DNA或RNA)直接运输到细胞内。这些就是转染的过程,转染的目的是促进蛋白合成,调节基因表达,促进细胞生长与发育等,目前越来越多地被用到功能研究中。
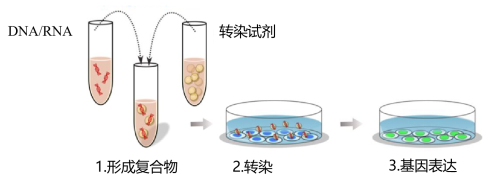
图1. DNA/RNA转染过程
(图片来源:图片来源于网络)
根据导入的核酸在目的细胞中存活时间的长短,可以将转染技术分为瞬时转染和稳定转染。也可以根据转染方式的不同,分为化学转染,物理转染、和生物转染方法。例如脂质体转染、阳离子聚合物PEI转染、电转、显微注射、以及慢病毒包装转染等等。
但是,没有一种转染试剂可以满足所有的实验要求。必须根据您的细胞类型(贴壁细胞、悬浮细胞)、外源核酸种类(DNA、RNA)、基因表达时间、细胞毒性、转染效率等,操作是否简便等因素,挑选出最理想的转染试剂。
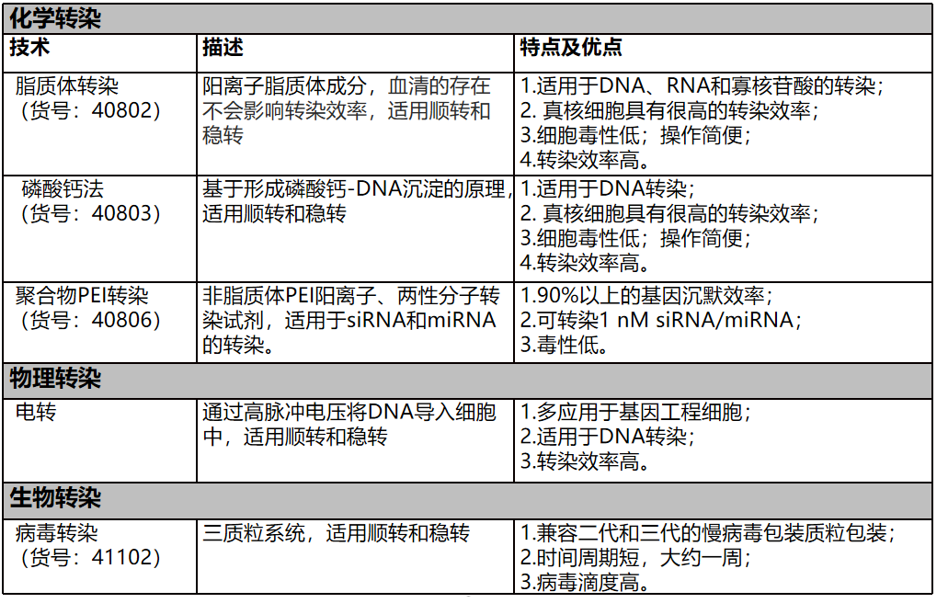
图2. 不同转染方法的原理和优点
在细胞转染过程中,即使选对了合适的细胞转染试剂,还是不可避免会出现各种令人头疼的问题,例如,转染效率低,细胞死亡,重复性差等问题。对于这些问题,我们接下来会详细剖析。
2.1 转染前
1)核酸纯度不够,比如DNA/RNA不纯、质粒中含有内毒素、核酸不完整、核酸浓度过低均会导致转染效率低。建议使用高纯度的DNA或RNA有助于获得较高的转染效率。
2)要检测所用的无血清培养基与转染试剂的相容性,已知CD293, SFMII, VP-SFM 与转染试剂不相容。
3)用了含有血清的培养基制备转染复合物。血清会降低复合物的形成。建议用无血清培养基稀释DNA/RNA和转染试剂。
4)DNA或RNA的复合物形成的比例,一般DNA(µg):转染试剂(µL)=1:2~1:3;而RNA(ng):转染试剂(µL)=9:1~3:1。
5)复合物孵育时间过短,未能充分形成复合物。建议复合物孵育时间10~20 min。
6)转染试剂保存不当,降低转染效率。保存在4 ºC冰箱,不可冻存,避免反复长时间开盖。
2.2 转染时
7)细胞密度过低或过高。DNA转染细胞密度90%~95%,RNA转染细胞密度30%~50%。
8)细胞生长状态不佳。清除支原体、真菌、细菌等污染,保证提供新鲜的生长培养基。
9)转染时细胞上清液中含有抗生素、生长因子等,大大降低转染效率。
2.3 转染后
10) 转染时间过短。一般质粒表达水平在24~48h,mRNA表达水平在24~72 h,蛋白表达水平在48~96 h。
3.1 转染前
1)核酸纯度不纯也会造成细胞毒性。要确保质粒中无内毒素,使用高纯度的DNA或RNA会降低细胞毒性。
2)转染试剂过量。优化转染试剂的用量,以及优化复合物的比例。
3)要检查稀释复合物的培养基与细胞的相容性,已知DMEM培养基对一些昆虫细胞系有毒性。建议选择合适的培养基。
3.2 转染时
4)细胞密度过低,会导致部分细胞死亡。DNA转染细胞密度90%~95%,RNA转染细胞密度30%-50%。
5)细胞生长状态不佳。清除支原体、真菌、细菌等污染,保证提供新鲜的生长培养基。
3.3 转染后
6)转染后目的蛋白的过度表达对细胞产生毒性。建议及时更换新鲜培养基,或者添加一些营养物质。
7)转染后表达蛋白对细胞产生毒性。建议换一种细胞系重新转染。
8)转染时间过短,就进行抗性筛选。一般质粒表达水平在24~48h,mRNA表达水平在24~72 h,蛋白表达水平在48~96 h。
9)抗性筛选时,加入的抗生素浓度过高。适当降低抗生素的浓度。

4.1 转染前
1)移液误差。将DNA/RNA和转染试剂充分打匀后,用移液器缓慢均匀的吸取,避免产生误差。
2)制备复合物时,未充分混匀。将DNA/RNA和转染试剂轻轻混匀,并保证相同的孵育时间。
4.2 转染时
3)细胞密度存在差异。一般在特定的密度范围内,细胞密度越低,转染效率越低,相反越高。
4)细胞生长状态存在差异。好的细胞状态,转染效率越高。
5)细胞传代次数不同。对于多次传代的细胞,细胞的基因组和表型都会发生变化,不建议使用传代次数过多的细胞进行转染实验。
4.3 转染后
6)转染时间不一致,表达的蛋白水平会有差异。
已发表文章
|
应用场景 |
名称 |
货号 |
规格 |
|
细胞类型:贴壁/悬浮 核酸类型:DNA、siRNA |
40802ES02 |
0.5 mL |
|
|
40802ES03 |
1.0 mL |
||
|
40802ES08 |
5×1 mL |
||
|
细胞类型:贴壁/悬浮 |
40803ES70 |
200 T |
|
|
用途:病毒感染、DNA转染 |
40804ES76 |
500 μL |
|
|
40804ES86 |
5×500 μL |
||
|
细胞类型:悬浮 |
40805ES02 |
0.5 mL |
|
|
40805ES03 |
1.0 mL |
||
|
40805ES08 |
5×1 mL |
||
|
细胞类型:贴壁/悬浮 |
40806ES01 |
0.1 mL |
|
|
40806ES02 |
0.5 mL |
||
|
40806ES03 |
1.0 mL |
||
|
细胞类型:贴壁/悬浮 |
40808ES02 |
0.5 mL |
|
|
40808ES03 |
1 mL |
||
|
40808ES08 |
5×1 mL |
||
|
细胞类型:贴壁/悬浮 |
40809ES01 |
0.1 mL |
|
|
40809ES03 |
1 mL |
||
|
细胞类型:贴壁/悬浮 |
40815ES03 |
1 g |
|
|
40815ES08 |
5×1 g |
||
|
细胞类型:贴壁/悬浮 |
40816ES02 |
100 mg |
|
|
40816ES03 |
1 g |
||
|
细胞类型:293 |
40820ES04 |
1.5 mL |
|
|
40820ES10 |
10 mL |
||
|
40820ES60 |
100 mL |
||
|
细胞类型:293 核酸类型:DNA 用途:AAV/LV载体大规模生产 |
40821ES10 |
10 mL |
|
|
40821ES60 |
100 mL |
||
|
40821ES80 |
1 L |
HB20200917
