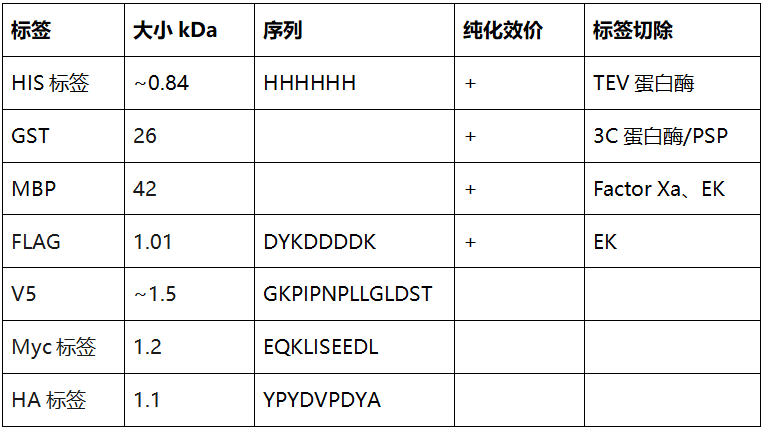
靶标伴“His”,蛋白纯化明明白白!
蛋白纯化是将目标蛋白从实验样本的总蛋白中分离出来,同时仍保留目的蛋白的生物学活性及化学完整性。在构建载体阶段,除了一些必要的表达元件,还需要考虑的密码子优化以及标签的选择。选择合适的标签不但有利于蛋白的纯化,促进蛋白的可溶性,同时也不能影响蛋白的结构功能和下游应用。以下简单列举几个常见蛋白标签:
表1. 不同蛋白纯化标签介绍
His-Tag 为何会逐渐成为分离纯化蛋白质等生物工程产品最有效的技术之一。其主要优势在于:
高序列兼容性:N-端的His-tag与细菌的转录翻译机制兼容,有利于蛋白表达;
小序列影响小:His-tag非常小,His-tag对目的蛋白本身特性几乎没有影响,不会改变目的蛋白本身的可溶性和生物学功能;且在融合蛋白结晶后对蛋白的结构没有影响;
免疫原性低:His-tag的免疫原性相对较低,可将纯化的蛋白直接注射入动物体内进行免疫并制备抗体;
联合使用性强:与其他的亲和标签构建成亲和标签,并可用于多种表达系统,纯化的条件温和;
适用范围广:his标签融合蛋白的适用范围也较广,即可用在非离子型表面活性剂存在的条件下纯化,也可以在变性条件下进行纯化。前者通常用来纯化疏水性强的目的蛋白,而后者则通常纯化包涵体蛋白。
因此,His逐渐成为了蛋白纯化的首选标签。
Yeasen生物自主研发的HisSep Ni-NTA Agarose Resin以高度交联的琼脂糖凝胶为基质,通过化学方法偶联四配位的氮川三乙酸(NTA)为配体,螯合镍离子(Ni2+)后,形成非常稳定的八面体结构,镍离子处于八面体的中心,这样的结构可保护镍离子免受小分子的进攻,与Ni-IDA树脂相比,更加稳定,可以耐受一定浓度的还原剂、变性剂或耦合剂等苛刻条件。已经成为实验室纯化His标签蛋白不可或缺的树脂之一。
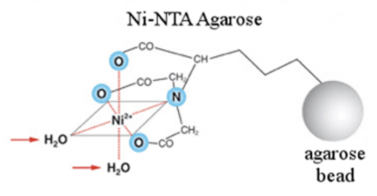
图1. His树脂的产品原理图
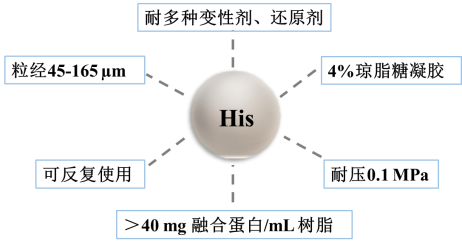
图2. His树脂的产品特性
1)装柱:将HisSep Ni-NTA Agarose Resin借助重力的作用装入合适的纯化重力柱中;
2)清洗:3-5倍柱体积去离子水冲洗重力柱;
3)平衡:至少5倍柱体积的Lysis Buffer 平衡含有填料的重力柱;
4)上样:注意控制加样速度,耐压0.1 MPa,流速控制在10滴/min,确保目的蛋白与Ni2+充分接触,以提高纯化得率;
5)洗杂,低浓度咪唑的缓冲液进行洗杂;
6)洗脱:使用5-10倍柱料体积Elution Buffer洗脱,收集洗脱液即目的蛋白溶液。
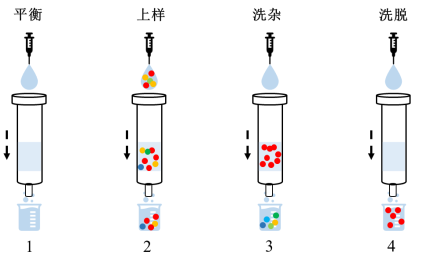
图3. His蛋白纯化简易流程图
测试产品:
1、某知名品牌his纯化产品;
2、大量生产的FF高流速产品;
3、小样生产的FF高流速产品;
4、本次生产的普通级别的his树脂(20502ES);
缓冲液:各个处理组均为1ml树脂纯化200 ml菌液;洗杂使用25mM的咪唑,洗脱液为250mM的咪唑。
测试报告一:His纯化树脂结合效率测试,与市场知名品牌进行对比,Yeasen研发的20502ES HisSep Ni-NTA Agarose Resin (4号)具有良好的结合效率。如下图:
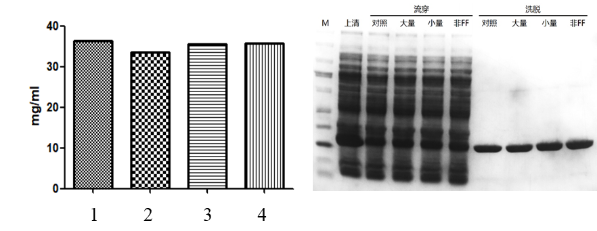
图4. His纯化树脂结合效率测试
测试报告二:以常利用的变性剂尿素为例,分别进行了不同产品在8M尿素下耐受性测试, 20502ESHisSep Ni-NTA Agarose Resin (4号)对尿素的耐受良好,与市场知名品牌无差异。如下图:
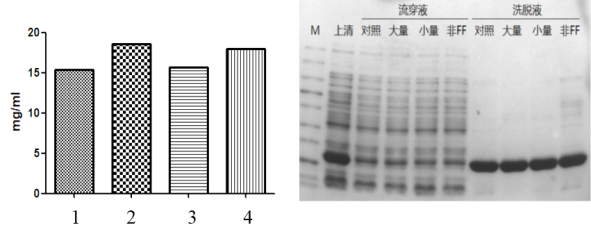
图5. His树脂对8M尿素耐受性测试
测试报告三:对于20502ES HisSep Ni-NTA Agarose Resin(4号)进行了批次检测稳定性测试,从结果看批次间差异基本控制在5%以内,以保证更好的稳定性。如下图:
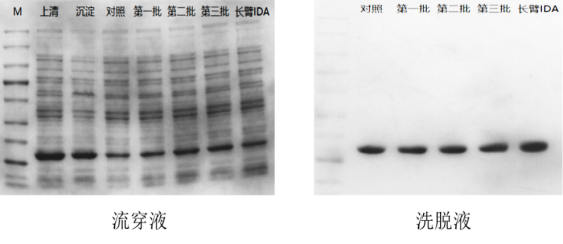
图6. His纯化树脂的批次间比较
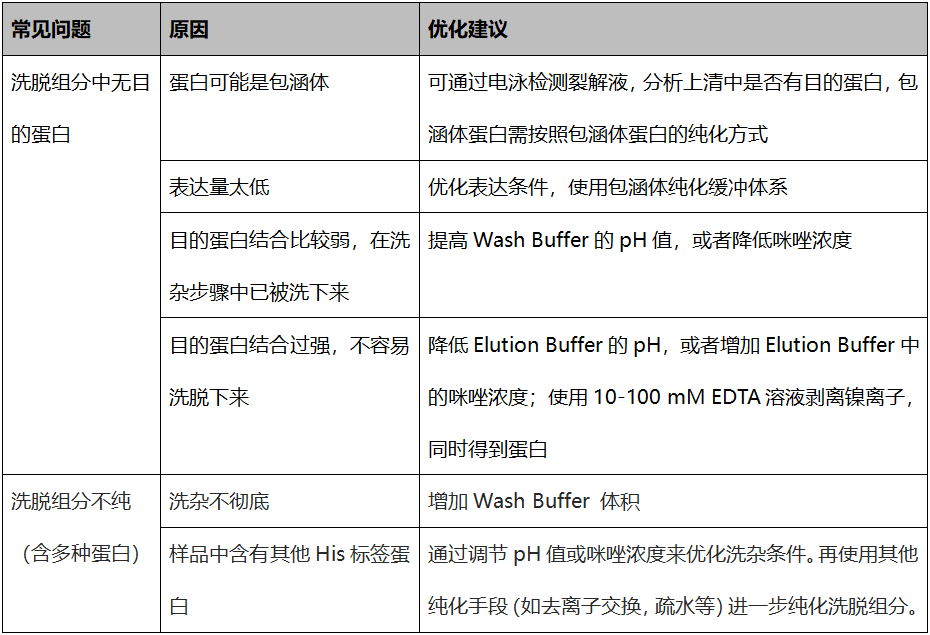
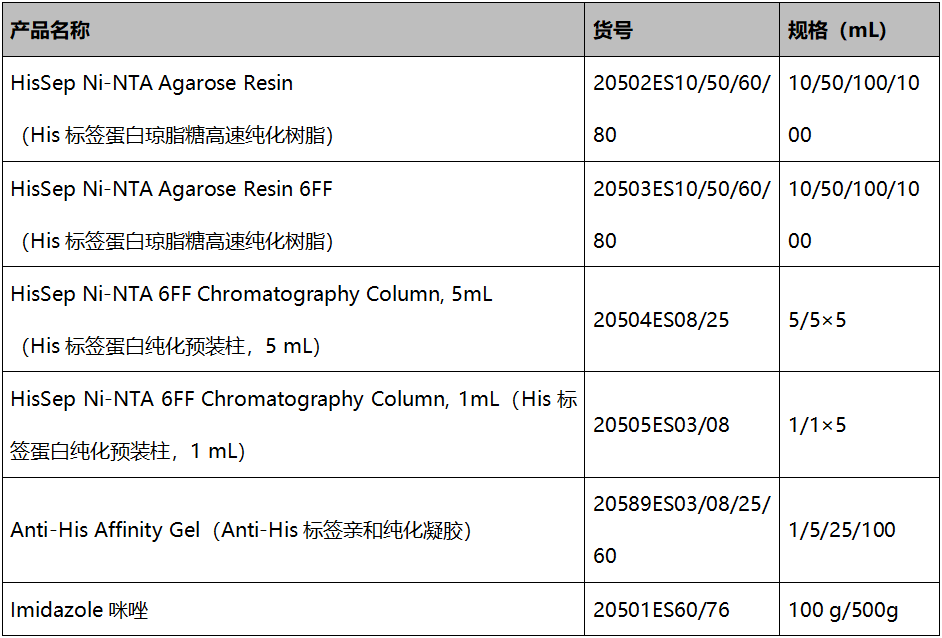
|
应用 |
货号 |
品名 |
规格 |
价格(元) |
|
His标签 蛋白纯化
|
20502ES10 |
|
10 mL |
678.00 |
|
20502ES50 |
50 mL |
2848.00 |
||
|
20502ES60 |
100 mL |
5328.00 |
||
|
20503ES10 |
|
10 mL |
798.00 |
|
|
20503ES50 |
50 mL |
3358.00 |
||
|
20503ES60 |
100 mL |
5838.00 |
||
|
20504ES08 |
|
5 mL |
728.00 |
|
|
20504ES25 |
5×5 mL |
2938.00 |
||
|
20505ES03 |
|
1 mL |
298.00 |
|
|
20505ES08 |
5×1 mL |
1048.00 |
