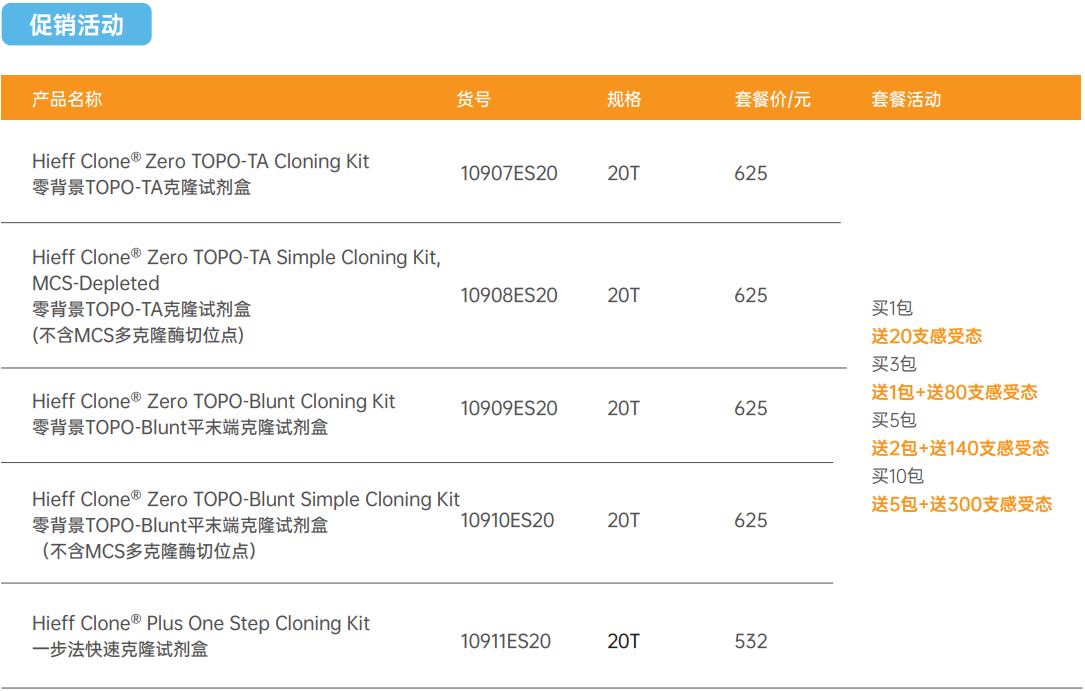
“同源重组技术” 一步法快速克隆技术常见问题集
过去
提起“分子克隆”或“载体构建”这两个词,大家可能先想到的是传统“酶切酶连法”,即用限制性内切酶产生黏性末端,通过碱基互补配对,T4 DNA Ligase连接两个片段的克隆方法。
近年
“同源重组技术”逐渐受到科研人员的欢迎,如翌圣Hieff Clone®一步法快速克隆技术。相比之下,同源重组技术操作更加简单,不受到酶切位点的限制,可一次进行多个片段的拼接,大大的提高了克隆效率。
虽然同源重组技术操作简单,但毕竟实验过程是环环相扣的,一旦某个细节处理不好,都可能导致实验失败。为此,小编精心整理了同源重组实验的常见问题,并给出了可能的原因和解决方案。希望新手们在遇到类似问题时可快速判断可能的原因,节省时间,更顺利的完成实验。
常见问题分类:
无克隆、假阳性、菌落PCR无条带、酶切鉴定多条带
出现无克隆的现象,可能的原因主要是连接不成功或连接成功,但转化失败。具体原因分别如下:
1、 连接不成功
|
可能原因 |
解决方法 |
|
1)引物设计错误。 |
1)设计原则:同源臂(15-25 bp,GC含量40-60%)+酶切位点(根据实验需求保留或删除)+基因特异性引物。 2)判断方法:可用翌圣无缝克隆引物设计软件核对 |
|
2)载体与目的片段使用比例失调。 |
1)载体和目的片段浓度测定方法:常用吸光度法或琼脂糖电泳法。 2)载体与目的片段添加比例: ①单片段建议:最适载体与目的片段摩尔比为1:2-1:3,载体使用量为0.03 pmol;目的片段使用量为0.06-0.09 pmol。 ②多片段建议:最适DNA使用量为每片段(含线性化载体)0.03 pmol。 |
|
3)载体与目的片段不纯。 |
1)推荐对线性化载体、PCR产物进行胶回收纯化。 2)纯化产物建议溶解在pH8.0的ddH2O中保存。 3)若为未纯化的DNA,加入总体积不超过反应体系体积1/5。 |
|
4)操作问题或试剂盒失效。 |
建议做试剂盒附带的阳性对照实验。判断方法: 1)若阳性对照有克隆并检测为阳性,则排除试剂盒问题。 2)若阳性对照无克隆,可能是操作问题或试剂盒失效,建议换其他人或换试剂盒进行阳性对照实验,进一步确定问题。 |
2、 连接成功,但无克隆
|
可能原因 |
解决方法 |
|
1)感受态细胞效率低,如< 107 cfu/μg。 |
建议用转化效率>107 cfu/μg的感受态细胞。 判断方法:可转化0.1ng质粒(如PUC19),观察克隆数,若生长大于1000个菌斑,则转化效率大于107cfu/μg。 |
|
2)抗生素种类错误。 |
建议将未线性化载体转化涂板。 判断方法:若未长克隆,则可能是抗性种类错误或浓度过高。需检查质粒图谱确认抗性或确认最适浓度。 |
出现假阳性的情况,主要表现有两种,克隆不含插入片段或含有错误的插入片段。具体原因分别如下:
1、克隆不含插入片段(空载)
|
可能原因 |
解决方法 |
|
1)载体线性化不完全。 |
建议将已制备的线性化的载体转化涂板。 判断方法:如果长克隆较多,则表示线性化不完全。建议优化酶切体系。 |
|
2)体系中混入了相同抗性的环状质粒。 |
1)产生原因: ①以反向PCR方式进行载体线性化,残留环状质粒模板导致。 ②目的基因PCR模板为与载体相同抗性的环状质粒,残留环状 质粒模板导致。 2)判断方法:将已制备的线性化载体和目的片段分别转化涂板,如果长克隆较多,则表示有相同抗性的环状质粒混入。建议PCR扩增产物先用DpnI 消化模板后,再进行胶回收纯化处理或直接进行胶回收纯化处理,去除残留的环状模板质粒导致的假阳性。 |
2、克隆含有错误的插入片段
|
可能原因 |
解决方法 |
|
1)PCR产物混有非特异扩增产物。 |
1)可能情况:PCR扩增目的基因时有非特异条带出现,未进行胶回收纯化。 2)解决方案: ①优化PCR体系,提高特异性; ②胶回收PCR产物; ③鉴定更多的克隆。 |
|
2)片段缺失。 |
1)可能情况:载体或片段有多个同源重复序列。 2)解决方案:借助网站或软件进行序列比对(如NCBI, Vector NTI等)。 |
出现菌落PCR无条带的现象,可能与PCR扩增或重组连接有关,具体原因分别如下:
|
可能原因 |
解决方法 |
|
1)菌落PCR引物错误。 |
建议用载体的通用引物进行菌检,或至少使用一条通用引物。 |
|
2)PCR体系或程序不合适。 |
1)可能情况:用目的片段引物和载体通用引物扩增都无产物。 2)解决方案: ①优化PCR体系、程序; ②提取质粒,以质粒做模板PCR验证; ③换酶切法鉴定克隆。 |
|
3)连接失败。 |
1)判断方法:目的引物或一端载体通用引物,另一端目的引物扩增无条带,但载体通用引物扩增有条带,且大小符合空载。2)可能原因:载体线性化不完全。建议优化酶切体系。 |
|
可能原因 |
解决方法 |
|
重组载体上有多个相同的酶切位点。 |
1)换其他酶切位点进行酶切鉴定。 2)更换克隆鉴定方法,如换成菌落PCR或测序鉴定。 |
以上就是翌圣生物为大家整理的同源重组的常见问题及相应的建议,希望对大家有所帮助。如果还有其它更多关于同源重组的问题,欢迎留言或来电。如果您之前在用传统酶的切酶连技术,现对高效的同源重组技术跃跃欲试,那赶快行动起来吧!
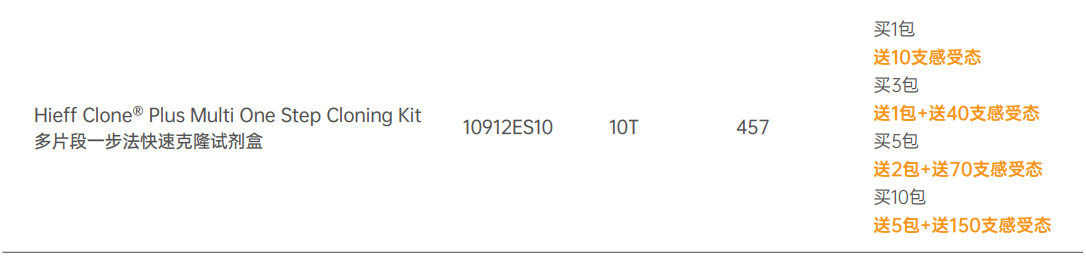
翌圣生物将提供高体验满意度的产品解决方案作为责任,追求从实验操作者的视角考量产品性能!在此考量下,为大家推荐以下匠心出品——Hieff CloneTM克隆系列产品。该系列产品克隆效率显著提升,可达95%以上。基于同源重组的方式,该系列产品无需考虑酶切位点,适用于任何载体和任意片段的连接。同时兼具连接反应时间短(20 min)、操作简单等优势。
产品定位
Hieff CloneTM一步法克隆
产品优势
● 无需考虑酶切位点:不受插入片段酶切位点的限制,适用于任何载体;插入片段兼容粘性或平末端。
● 设计简单:在插入片段的PCR扩增引物5’端引入20 bp左右与载体末端同源的序列即可。
● 快速:50℃,20 min即可完成重组反应。克隆阳性率可达95%以上。
● 应用广泛:可用于单片段或多片段定向克隆,也可结合Canace高保真酶,应用于定点突变。
客户反馈数据
高效、快速单片段连接
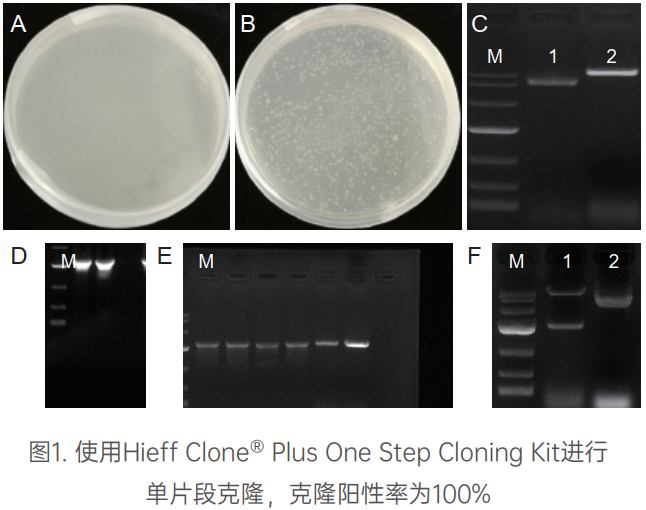
注. A: 阴性对照转化平板; B: 重组质粒转化平板; C: 1和2分别为原始载体和线性化载体浓度检测电泳图; D: 目的片段的浓度检测电泳图; E: 目的片段的菌落PCR鉴定电泳图; F: 1为重组质粒的酶切鉴定电泳图, 2为原始质粒酶切对照图; M: DL10000。pCAMBIA1300载体: 10217bp, 目的片段: 2352bp。
高效、快速多片段连接
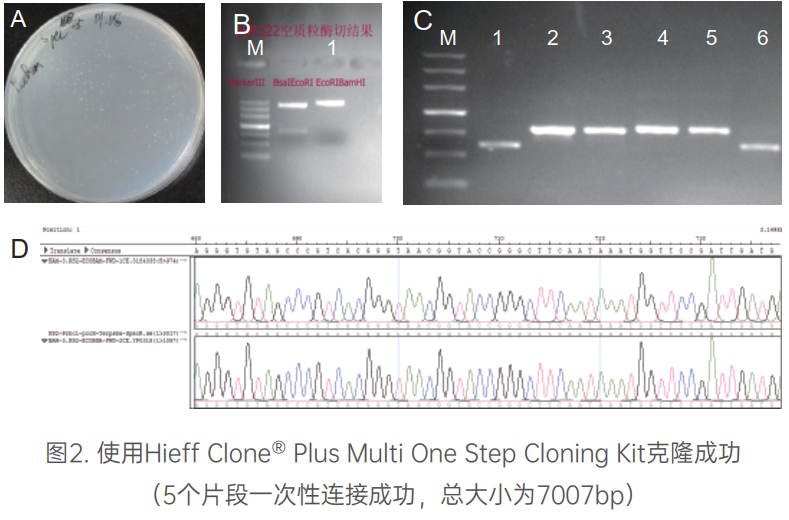
注. A: 重组质粒转化平板; B: 1为载体酶切后琼脂糖凝胶电泳图; C: 菌落PCR验证结果, 其中1为原始质粒对照电泳, 2-5为重组质粒, 仅检测867bp的一个目的片段, 6为假阳性; D: 阳性克隆测序结果; M:Marker II。pBR322载体:3996bp,目的片段:576bp+867bp+915bp+647bp。
发表部分文献
[1]. Liu C X, Li X, Nan F, et al. Structure and degradation of circular RNAs regulate PKR activation in innate immunity[J]. Cell, 2019.(IF 36.616)
[2]. Wang Y, Hu SB, et al. Genome-wide screening of NEAT1 regulators reveals cross-regulation between paraspeckles and mitochondria. Nat Cell Biol.2018 Oct;20(10):1145-1158.(IF 20.06)
[3]. Jiang, Y., et al., Plants transfer lipids to sustain colonization by mutualistic mycorrhizal and parasitic fungi[J]. Science, 2017.(IF 37.205)
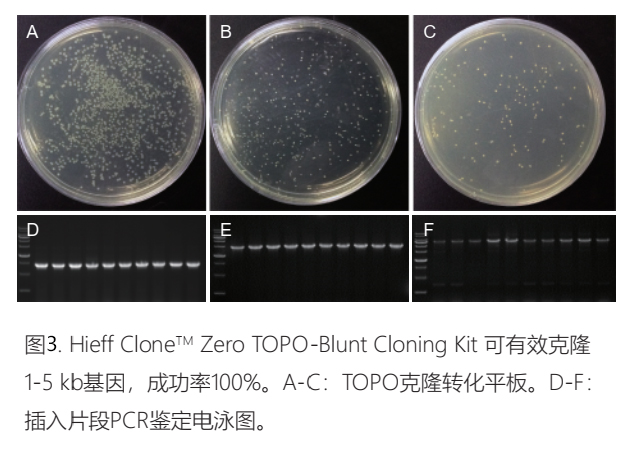
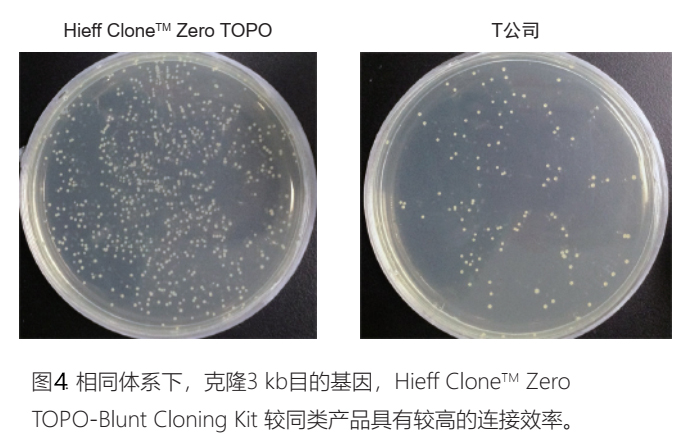
Hieff CloneTM TOPO克隆
产品优势
平末端和A末端PCR产物均可在瞬间(几秒钟-5分钟)完成连接;
无需并与和热休克,室温5分钟内完成转化;37℃ 10分钟复苏可以涂板;
客户反馈数据
发表部分文献
[1]. Jiang, Y., et al., Plants transfer lipids to sustain colonization by mutualistic mycorrhizal and parasitic fungi[J]. Science, 2017.(IF 37.205)
[2]. Xing, Y.H., et al., SLERT Regulates DDX21 Rings Associated with Pol I Transcription[J]. Cell, 2017. 169(4): p. 664-678.e16.(IF 30.41)
[3] Li X, Liu C X, Xue W, et al. Coordinated circRNA biogenesis and function with NF90/NF110 in viral infection[J]. Molecular Cell, 2017. (IF 14.7)
现Yeasen基于同源重组的Hieff Clone®克隆试剂盒正在火热促销中,还有感受态赠送哦。转化时感受态是决定因素,使用高效率感受态,会极大提高同源重组的成功率,能够让实验事半功倍,用过的都说好。赶快扫码订购吧~