干货分享|磁珠常见问题与解决方案
高通量测序技术的跨越式发展,使测序能力大幅上升。在整个NGS工作流程中,磁珠是必不可少的产品。
磁珠通过磁颗粒活性基团在一定条件下可与核酸结合和解离的原理,将样本中目的片段分离。可实现对核酸样本的高通量自动化操作,广泛应用于基因测序以及分子诊断领域。
看起来很简单的纯化/分选实验,却在实际实验中有各种意外的情况。那关于磁珠产品选择和产品使用方面有什么需要注意的事项呢?接下来小翌将从磁珠的外观、储存、应用和使用效果逐一对症分析,希望能帮助大家了解磁珠实验中的那些事。

Q:如何从磁珠的外观区分磁珠是否正常?
A:正常磁珠静置时,微珠与buffer分层,聚集在瓶身底部,使用前震荡混匀,微珠均匀分布在buffer中。非正常磁珠由于 β-巯基乙醇、DTT、pH差值大等因素,影响磁珠的均一性,使得磁珠粘稠,聚集成块或出现挂壁的现象。

图1. 正常磁珠外观图

图2. 非正常磁珠外观图
Q: 不小心将磁珠放到-20℃,但未结冰,是否可以继续使用?
A:不建议使用。因为低温会破坏磁珠的结构,使得磁珠的抓取效率降低,影响磁珠回收性能。
Q:磁珠未开封的时候4℃保存,开封后一直室温保存使用,是否会影响磁珠的回收性能?
A:室温放置对磁珠的回收性能会有一定影响,不建议室温放置太久,使用完后建议4℃保存。PEG分离效果易受pH、温度等影响。
Q:磁珠分选的原理是什么?
A:第一轮磁珠结合分子量较大的DNA,通过丢弃磁珠去除这部分产物;第二轮磁珠结合剩余产物中分子量较大的DNA,通过丢弃上清去除分子量较小的DNA。
初始样品中的很多组分都会干扰双轮磁珠分选效果。因此,当分选方案执行位置不同时,双轮磁珠使用量也不尽相同。
Q:产品的主要应用是什么?
A:产品主要应用于高通量测序DNA片段的纯化和分选。对于PCR或者酶切DNA产物的纯化也可以使用。可以有效去除dNTP,引物,引物二聚体,接头,接头二聚体,盐离子等杂质。
Q:产品可以重复使用吗?
A:产品不可以重复使用,乙醇洗脱步骤将影响磁珠表面活性基团性能。
Q:与AMPure XP相比,怎么样?
A:我们的产品制备原材料完全进口,可以完美替代AMPure XP Beads。在使用方法,文库大小分布和回收效率上,与AMPure XP Beads完全一致,您可以直接按照AMPure XP Beads的操作方式使用,无需摸索条件。
Q: 磁珠可以吸附ssDNA吗?
A:可以回收单链DNA,具体性能没有测试过。附图是Beckman磁珠回收单链DNA的数据,可以作为参考。
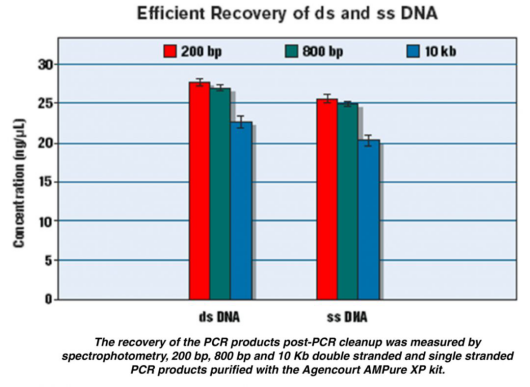
图3. XP磁珠回收单链DNA效果图
Q: 分选磁珠可以纯化gDNA吗?
A:翌圣分选磁珠测试过最大20kb的片段,回收率>90%。基因组 DNA 未测试过,测试时,由于大DNA与磁珠结合的非常紧,建议尽量增加洗脱液体积,避免干燥时间过久。
Q: 分选磁珠是否可以进行片段产物纯化?
A: 根据客户反馈结果,分选磁珠可以进行片段产物的纯化。0.8×磁珠可以吸附 200 bp 以上的产物,通过去除上清即可对 200 bp 以下的片段进行去除;1.4×磁珠可以吸附 150 bp 以上的产物,通过去除上清即可对 150 bp 以下的片段进行去除。
Q:磁珠的DNA结合能力怎么样?
A:在目前的磁珠体系中,磁珠的吸附能力均为过饱和,客户不必担心磁珠结合能力不足的情况。根据已知的报道,每1 μL磁珠可以结合7 μg DNA。
Q: 使用磁珠吸附小片段的时候,大片段也会吸附上来吗?
A: 磁珠优先吸附大片段,增大磁珠投入量时,磁珠会在吸附大片段的基础上增强吸附小片段的能力。
举例说明:参考磁珠纯化分选表,100 μL样本,加入80 μL磁珠Cat#12601,此时磁珠上吸附的是>350 bp的片段,但是,当磁珠投入量至100 μL时,磁珠上吸附的是>200 bp的片段。
Q:分选磁珠是否可以用于提取DNA?
A:使用分选磁珠可以实现直接将样本裂解后用磁珠将其中的gDNA提取出来,可能效率没有专用试剂盒的高,因为我们这款磁珠的定位是在纯化和分选。
Q:使用磁珠分选/纯化之后,还有小片段残留是怎么回事?
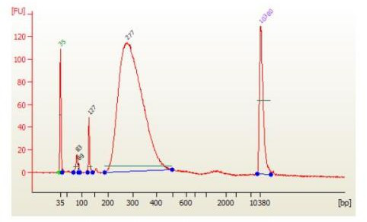
图4. 二聚体残留效果图
A:小片段残留大部分是接头二聚体(127bp)/引物二聚体(80bp)。若纯化,降低磁珠比例;若分选:可适当降低二轮磁珠比例可有效改善此类情况。
Q:磁珠回收率低可能的原因是什么?
A:1)磁珠与DNA混匀不充分,未能充分吸附。建议反应体系充分混匀;
2)磁珠比例不对,建议按照说明书进行选择合适的比例;
3)孵育时间不足,保证孵育时间至少5 min;
4)磁珠分选时,二轮磁珠吸附的时候吸到磁珠。可在200 μL 枪头前串联 10μL枪头用于移液,可防止吸到磁珠;
5)磁珠洗涤时的乙醇非现配,导致乙醇浓度过低,建议乙醇浓度不低于70%;
6)干燥过度:磁珠长时间干燥导致表面龟裂,DNA难以洗脱,得率降低;建议干燥时间不宜过长,表面刚出现龟裂即可;
7)洗脱液体积不足:最终洗脱液应完全覆盖管内磁珠。
Q:纯化后DNA在后续实验中表现不理想。
A:由乙醇残留引起,可能是操作时磁珠分离时间过短或磁力器磁力较弱,洗脱步骤中吸取上清速度过快等。建议确保在最后一步洗涤结束后,溶液中无残留乙醇。磁珠可于室温干燥5-10分钟,使乙醇完全干燥。
Q: 使用 12601 分选磁珠,分选出的文库大小不对称是怎么回事?
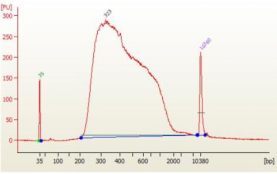
图5. 分选文库大小不对称效果图
A:操作问题,磁珠比例应严格按照说明书,另外移液时为避免吸到磁珠,底部需残留 1-2μL 液体。
|
产品类型 |
名称 |
货号 |
规格 |
价格 |
|
回收100-200 bp/100-400 bp |
12599ES03 |
1 mL |
466.00 |
|
|
12599ES08 |
5 mL |
1666.00 |
||
|
12599ES56 |
60 mL |
9106.00 |
||
|
专注DNA小片段的回收 |
12600ES03 |
1 mL |
386.00 |
|
|
12600ES08 |
5 mL |
1386.00 |
||
|
12600ES56 |
60 mL |
7586.00 |
||
|
12600ES75 |
450 mL |
29886.00 |
||
|
完美替换XP |
12601ES03 |
1 mL |
296.00 |
|
|
12601ES08 |
5 mL |
986.00 |
||
|
12601ES56 |
60 mL |
6286.00 |
||
|
12601ES75 |
450 mL |
26186.00 |
||
|
替代柱法纯化RNA |
12602ES03 |
1 mL |
366.00 |
|
|
12602ES08 |
5 mL |
1066.00 |
||
|
12602ES56 |
60 mL |
4266.00 |
||
|
12602ES75 |
450 mL |
38566.00 |
||
|
分离纯化poly(A)尾巴的mRNA |
12603ES24 |
24 T |
616.00 |
|
|
12603ES96 |
96 T |
2266.00 |
HB200526
