基因治疗领域的后起之秀-mRNA疫苗
据路透社3月15日报道:美国政府正试图说服德国公司CureVac搬迁到美国并垄断其疫苗生产,而德国政府希望该公司能留在本国。那么,CureVac公司拥有什么重要的东西竟让两个国家政府直接出面进行争夺?答案就是——mRNA疫苗制备技术。
什么是mRNA疫苗
mRNA疫苗是将RNA在体外进行相关的修饰后传递至机体细胞内表达并产生蛋白抗原,从而导机体产生针对该抗原的免疫应答,进而扩大机体的免疫能力[1,3]。
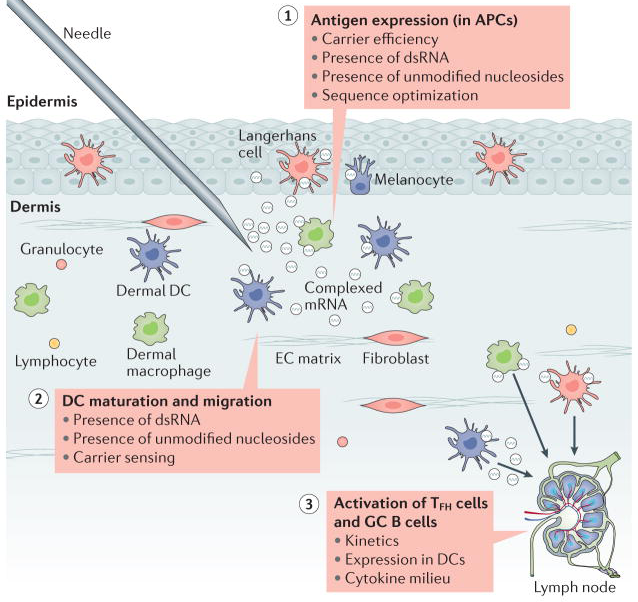
图1:直接注射mRNA疫苗效果示意图[2]
mRNA疫苗的分类
mRNA疫苗分为非复制性mRNA(nonreplicating mRNA)和自扩增mRNA(self-amplifying mRNA)两类:自扩增mRNA不仅编码目标抗原,而且还编码能够使细胞内RNA扩增和蛋白表达的复制机制。非复制性mRNA疫苗仅编码目标抗原并包含5′和3′非翻译区(UTR),它们提供对适应性和先天免疫力的综合刺激,即原位抗原表达和危险信号传递,具备有以下应用特性[2,3]
●可提供对适应性和先天免疫力的综合刺激,即原位抗原表达和危险信号传递
●可以诱导“平衡”免疫反应,包括体液和细胞效应因子以及免疫记忆
●可结合不同的抗原而不会增加疫苗配制的复杂性
●可通过重复性的疫苗接种实现持续的免疫潜力提升,并且对载体没有或有很少的免疫反应
●热稳定mRNA疫苗可简化疫苗的运输和储存
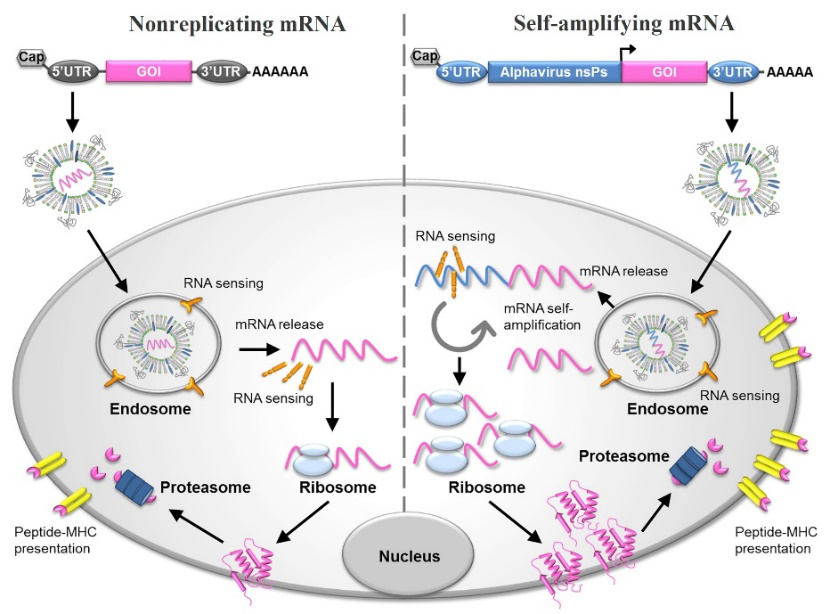
图2:mRNA疫苗的示意图及其抗原表达的机制[4]
mRNA疫苗的特点
相比传统疫苗,mRNA疫苗生产工艺简单、开发速度快、无需细胞培养、成本低。相较与DNA疫苗,mRNA疫苗无需进入细胞核,没有整合至宿主基因组的风险,半衰期可以通过修饰进行调整。
表1:mRNA疫苗的优缺点
|
|
优点 |
缺点 |
|
mRNA 疫苗 |
研发快速,疫苗生产仅需40天 |
mRNA在生理条件下的不稳定性,易降解 |
|
无需任何的核定位信号、转录 |
引发不必要的免疫反应 |
|
|
不会整合到基因组,避免可能的治疗性突变 |
安全性核有效性有待验证 |
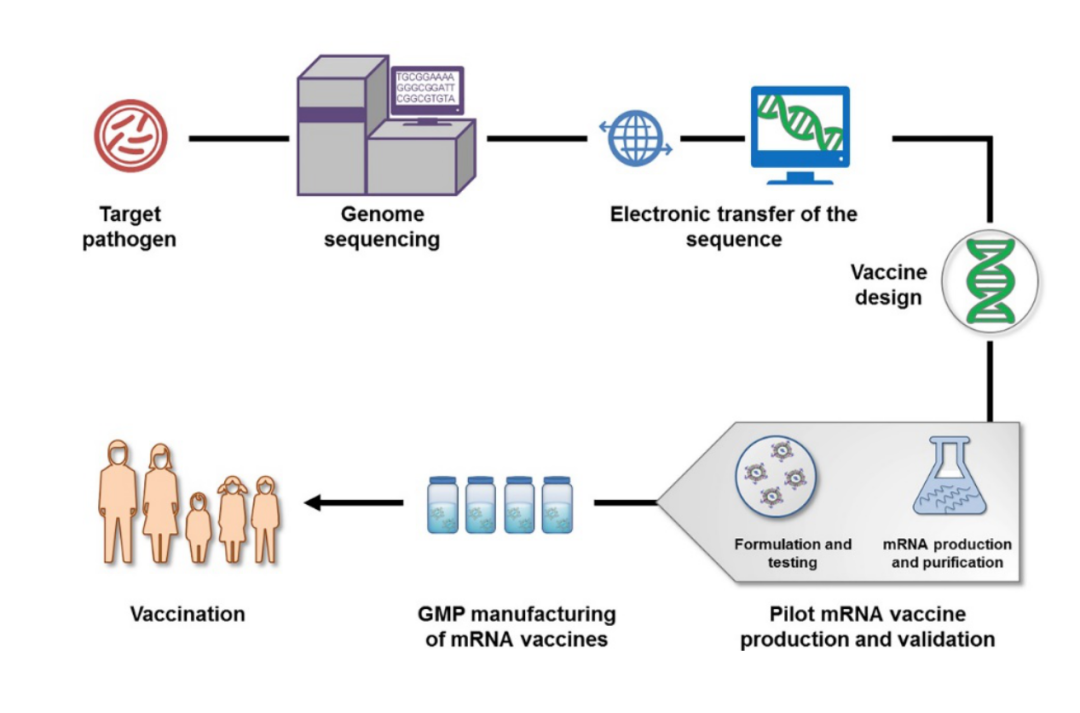
图3:mRNA疫苗生产制备流程图[4]
mRNA疫苗制备的改进策略
由于mRNA自身的稳定性差、易被组织内的核酸酶降解、进入细胞的效率较低、翻译效率较低等问题,这些缺陷限制了mRNA疫苗的应用,不同的递送载体对mRNA疫苗的稳定性和翻译效率也起到非常关键的作用,递送载体可分为病毒载体和非病毒载体(包括脂质体、非脂质体、病毒、纳米颗粒等)。因此需要进行相关的改进措施,以下是mRNA制备的药理学改进策略[2]
合成帽类似物或使用加帽酶通过与真核翻译起始因子4E(EIF4E)结合来稳定mRNA并增加蛋白翻译
调节5′-非翻译区(UTR)和3′-UTR中的元件来稳定mRNA并增加蛋白翻译
添加Poly(A)尾可使mRNA稳定并增加蛋白质翻译
修饰核苷来减少先天免疫激活并增加翻译
使用RNase III处理和快速蛋白质液相色谱(FPLC)纯化可降低免疫激活并增加翻译
优化序列或密码子来增加翻译
翻译起始因子和其他方法的共同递送来改变翻译和免疫原性
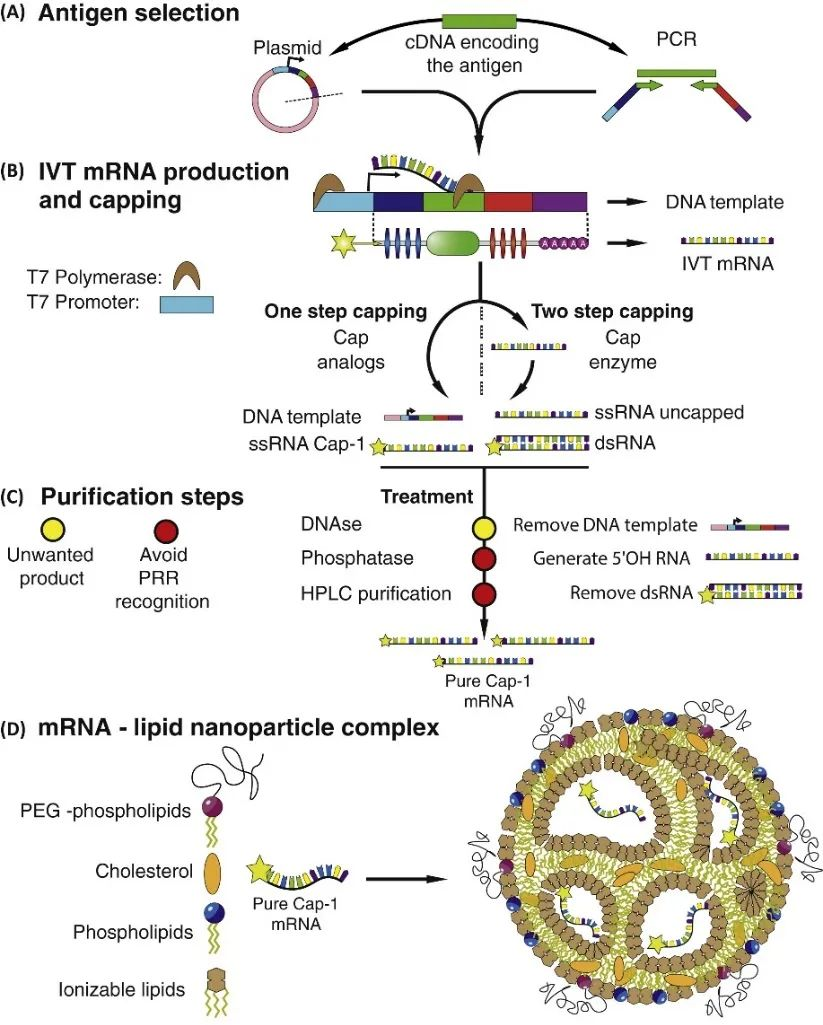
图4:体外转录(IVT)mRNA生产和装配过程[5]
相关公司及疫苗简介
目前,已有多家企业以mRNA为研究基础或拥有mRNA研发平台,部分产品也已进入临床研究阶段,相关信息如下表2、3所示。
表2:全球主要的mRNA疫苗公司概况
|
公司名称 |
成立时期 |
注册地 |
研究技术平台 |
|
Argos Therapeutics |
1997 |
美国 |
拥有先进的免疫疗法技术Arcelis平台
|
|
CureVac |
2000 |
德国 |
拥有RNActive、RNArt、RNAntibody、RNAdjuvant 技术平台 |
|
BioNTech |
2008 |
德国 |
拥有mRNA药物/疫苗、细胞治疗、抗体药物等药物研发平台 |
|
Moderna |
2010 |
美国 |
拥有mRNA技术、交付技术和制造流程mRNA转化药物平台 |
|
eTheRNA Immunotherapies |
2013 |
比利时 |
拥有基于APC激活mRNA平台开发新的免疫肿瘤疗法 |
|
斯微生物 |
2016 |
中国 |
拥有中国领先的mRNA药物平台和产品管线 |
注:以上信息均来自对应公司官网信息
表3:相关mRNA疫苗及药物临床进展概况
|
公司名 |
药物编号 |
适应症 |
临床进展 |
|
BioNTech |
BNT1222 |
Melanoma(黑色素瘤) |
Phase 2 |
|
BNT112 |
Prostate cancer(前列腺癌) |
Phase 1 |
|
|
BNT113 |
HPV16+ head and neckcancer1(HPV和头颈癌) |
Phase 1 |
|
|
CureVac |
CV8102 |
Melanoma、Adenoidcystic Carcinoma(黑色素瘤等肿瘤微环境调节) |
Phase 1 |
|
CV9202 |
NSCLC(非小细胞肺癌) |
Phase 1 |
|
|
CV7202 |
rabies virus(狂犬病病毒) |
Phase 1 |
|
|
CV7301 |
Influenza (流感) |
Pre-clinical |
|
|
Moderna |
mRNA-4157 |
Solid tumors(实体瘤) |
Phase 1 |
|
mRNA-4157 |
Melanoma(黑色素瘤) |
Phase 2 |
|
|
mRNA-1647 |
Cytomegalovirus (CMV,巨噬细胞病毒) |
Phase 1 |
|
|
mRNA-1893 |
Zika(寨卡病毒) |
Phase 1 |
注:以上数据信息均来自对应BioNTech 、CureVac 、Moderna公司官网公开信息(截止日期:20200330)
制备所需关键原料
mRNA疫苗的制备需要多种原料来保证疫苗的成功开发,翌圣生物作为国内分子酶产业创新领导者,通过分子酶双向技术平台、大规模蛋白发酵纯化技术平台,目前已成功开发各类分子酶相关原料的产品,并获得了广大用户的认可。
表4:相关mRNA疫苗所需原料
|
产品名称 |
货号 |
规格 |
|
10614ES84/92 |
2000/10000U |
|
|
10612ES84/92 |
2000/10000U |
|
|
10613ES92/97 |
10/50KU |
|
|
10621ES10/20 |
10/20 KU |
|
|
10620ES10/60 |
10/100U |
|
|
10611ES76/84 |
500/2000U |
|
|
10623ES50/60 |
50/100T |
|
|
10619ES02 |
0.5ml |
|
|
10132ES03 |
1ml |
|
|
10133ES03 |
1 Set (4 vial) |
应用展望
mRNA疫苗以其生产工艺简单、开发速度快、成本低等正越来越受到各方的关注,将在肿瘤、传染病及感染性疾病等预防和治疗领域有着广阔的应用前景。
【1】苗鹤凡, 郭勇, 江新香. mRNA疫苗研究进展及挑战[J]. 免疫学杂志, 2016(05):446-449.
【2】Pardi N , Hogan M J , Porter F W , et al. mRNA vaccines — a new era in vaccinology[J]. Nature Reviews Drug Discovery, 2018.
【3】Kramps T., Elbers K. (2017) Introduction to RNA Vaccines. In: Kramps T., Elbers K. (eds) RNA Vaccines. Methods in Molecular Biology, vol 1499. Humana Press, New York, NY.
【4】Maruggi G , Zhang C , Li J , et al. mRNA as a Transformative Technology for Vaccine Development to Control Infectious Diseases[J]. Molecular Therapy, 2019.
【5】Sergio Linares-Fernández, Céline Lacroix, ,Tailoring mRNA Vaccine to Balance Innate/Adaptive Immune Response,Trends in Molecular Medicine,Volume 26, Issue 3,2020,Pages 311-323.
