技术分享|小翌教你做双荧光素酶报告基因实验
荧光素酶生物检测技术诞生于1990年,已有30年的发展史。单荧光素酶检测系统到双荧光素酶检测系统的发展,为科研人员提供了更为严谨的实验手段。双荧光素酶报告基因检测系统在原有的基础上引入了海肾报告基因,可以排除不同组之间细胞生长状况、细胞数目以及转染效率带来的干扰,起到校正的作用,从而使实验结果更为可靠。其发光原理如下图1。
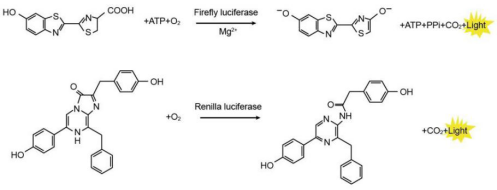
图1. 双荧光素酶发光原理
将靶基因的转录调控元件或5’启动子区克隆在Firefly luciferase基因的上游,或把3’-UTR区或lncRNA结合序列克隆在Firefly luciferase基因的下游,以研究启动子的强弱和转录因子对启动子的作用或miRNA对目的基因或lncRNA的调控作用。如图2。
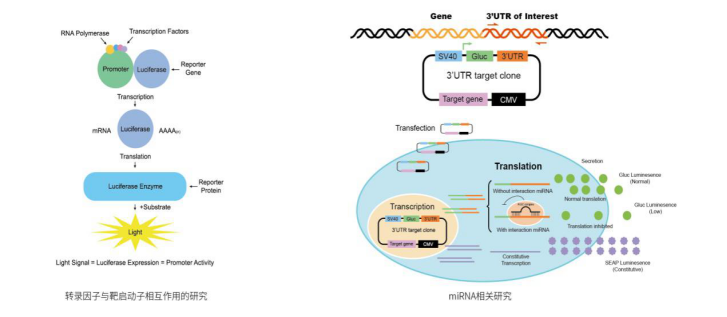
图2. 报告基因系统用于基因表达调控研究
1)启动子、增强子、转录因子的研究;
2 ) 信号转导通路的研究;
3) 蛋白质相互作用;
4) miRNA、LncRNA、siRNA等的研究。
……
双报告基因检测试剂盒多用于动物细胞中,也有相关科研人员以植物为研究对象。不同的研究对象其操作流程有一定的差异。这里为大家提供细胞、烟草叶片和原生质体这三种研究对象对应的操作流程:
1、制备重组质粒
2、共转染:将Luc/Ren载体和目的基因载体进行共转染,通常24-48h(选择转染效率较高的细胞如293T),载体的转染比例要进行摸索(如1:10、1:20、1:50、1:100),原则上海肾荧光素酶读值不盖过主报告基因读值为好。具体的转染流程参照相关说明书;
3、细胞裂解处理
a:对于贴壁细胞,吸尽细胞培养液,按照下表比例加入细胞裂解液,轻轻旋转培养皿或者培养板使裂解液完全覆盖细胞;
b: 对于悬浮细胞,离心弃去上清,按照下表比例加入裂解液;
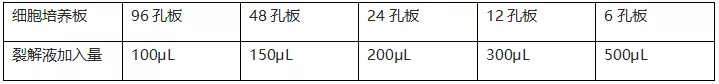
冰上孵育5min,充分裂解细胞。10000-16000rpm离心1min,取上清;
4、荧光检测(使用含有生物发光或化学发光模块的酶标仪)
取20 μL细胞裂解液,加至黑色酶标板中。加入100 μL 1×萤火虫荧光素酶反应液,震板混匀,检测萤火虫荧光素酶的活力; 加入100 μL 1×海肾荧光素酶反应液,检测海肾荧光素酶的活力。两个反应最好都在30min完成。
5、数据分析:实验结果为Luc值与Ren值之比。
1、制备重组质粒
2、农杆菌转化及培养:质粒转化比例需要摸索。转化后需过夜培养,OD600达到0.8以上即可;
3、利用无针头注射器注射叶片,(先用针头在叶片上扎个小孔)(注射烟草顶端以下第3-5片叶片);
4、暗培养1d,光照培养2d;
5、取叶片进行打孔,8mm-1.5cm即可;
6、在2mL的EP管中加入预冷的小钢珠,放入3-4片烟草叶盘并加入适量的液氮,使用仪器进行研磨破碎(45Hz,30s),加入100μL裂解液,10000-16000rpm离心2min,取上清20μL进行检测。
7、检测:方法同动物细胞。
1、原生质体的制备:不同植物原生质体的分离略有差异,请参考相关文献;
2、原生质体的计数与活力测定:取少量原生质体稀释液滴加在0.1mm的血球计数板上,在光学显微镜下观察计数。用0.01% FDA进行染色,在显微镜下对发绿色荧光的原生质体进行计数。计算原生质体的活力。
3、构建重组载体;
4、PEG-Ca2+介导原生质体的转化:用MMG溶液重悬原生质体。在1.5mL EP管中加入Luc、Ren载体(比例需摸索)、100μL 原生质体和110μL PEG4000-Ca2+溶液,黑暗处放置20min,加入W5终止反应,离心弃上清,用1mL W1溶液重悬原生质体并转移至细胞培养板中,25℃静置培养20h;
5、原生质体的裂解:将原生质体加入2mL离心管中,离心收集原生质体,加入100μL左右的裂解液,冰上孵育10min左右。10000-16000rpm离心5min。
6、检测:取20μL上清至1.5mL EP管中,检测方法同动物细胞。
Q1:如何选择海肾报告基因质粒?
A1:尽量选择中等强度的启动子,如TK启动子等,不要选择强启动子CMV、SV40等。海肾基因的表达活性应显著高于背景组,同时不干扰萤火虫荧光素酶报告基因的表达。
Q2:如何选择萤火虫报告基因质粒?
A2:原则上含有luc基因就可以,但是不同实验所需的载体有一定差异,如研究miRNA、转录因子的载体是不同的。小翌为大家提供了多种研究转录因子活性的报告基因载体,可以直接使用,详情见官网(https://www.yeasen.com/products/min/101),如果您要自己构建载体,要注意有些载体没有启动子,需要自行插入启动子,如pGL3 Basic。
Q3:psiCHECK-2的主报告基因是海肾报告基因,而不是萤火虫报告基因,能用于双荧光素酶报告基因检测实验吗?
A3:该质粒可以用于双荧光素酶报告基因检测实验,本试剂盒的检测原理是酶和底物的反应,两种酶经裂解处理后都会释放出来,所以使用该质粒不影响检测实验。最后的数值为Ren值与Luc值之比。
Q4:检测体系可以自行调整吗?
A4: 我们推荐20μL裂解液,100μL萤火虫荧光素酶底物,100μL海肾荧光素酶底物。底物的量可以适当调整,但是要保证底物是足量的。
Q5:数值低,什么原因造成的?
A5:可能是启动子活性、转染效率低、裂解不充分、底物失效、操作不规范等原因造成的,具体的原因需要实验者进行排查。
相关产品
|
产品名称 |
货号 |
规格 |
价格(元) |
促销价(元) |
|
11402ES60 |
100T |
1265.00 |
752.00 |
|
|
11402ES80 |
1000T |
9965.00 |
6852.00 |
|
|
11401ES60 |
100T |
349.00 |
/ |
|
|
11401ES76 |
500T |
969.00 |
/ |
|
|
11401ES80 |
1000T |
1748.00 |
/ |
