磁珠深度解析,真的非AMPure XP不可吗?
背景介绍
磁珠最初由挪威科技大学化学家John Ugelstad构想,经过改进,现常见的纳米级磁珠种类多样,分离原理因表面性质不同而异,但其材料和基本结构相似。磁珠的基础结构分为三层:最内层为聚苯乙烯,第二层包裹磁性物质Fe₃O₄,最外层为修饰的官能团(如羧基),可与核酸结合。不同表面基团决定了磁珠的下游应用,如核酸提取、纯化和生物素捕获等。
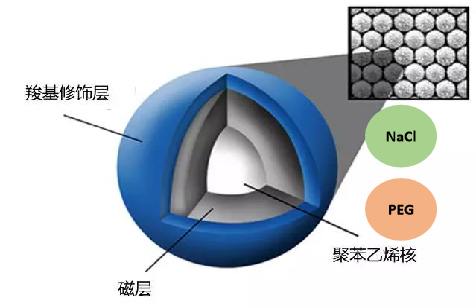
图1. 磁珠结构示意图
原理解读
商业化磁珠体系包括磁珠、PEG、盐离子等,影响DNA回收的因素主要是PEG、DNA大小与浓度、孵育时间等。其中,PEG是决定性因素。高浓度PEG和NaCl促使DNA脱去水化层,压缩为球状,暴露带负电的磷酸基团,通过Na+与磁珠表面的羧基形成“电桥”,使DNA吸附在磁珠上。去除PEG和NaCl后,水化作用解除离子键,DNA被纯化出来。不同长度的DNA可根据PEG和盐浓度变化选择性沉淀。
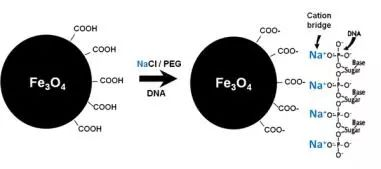
图2. 磁珠吸附DNA原理示意图
磁珠凭借其高通量,适用于自动化的特点在高通量测序中备受推崇,并广泛用于NGS建库中DNA的提取、纯化和分选。
核酸提取
磁珠法提取中,细胞裂解液作为蛋白变性剂,可裂解细胞并使核酸释放。磁珠带正电,易吸附带负电的核酸。结合后通过洗涤和磁场捕获去除杂质,最后用洗脱液解离核酸。纯化的DNA/RNA可用于PCR等检测。该方法广泛应用于诊断行业,且支持高通量、自动化的核酸提取。
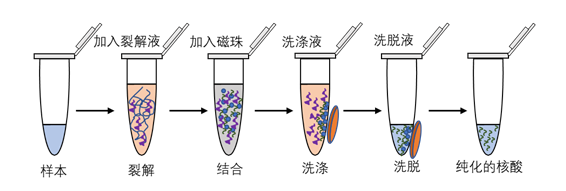
图3. 磁珠核酸提取流程示意图
DNA纯化
DNA纯化的目的是去除非目标片段。磁珠优先吸附大片段,通过控制磁珠比例可选择性吸附特定大小的DNA,丢弃上清中的小片段,最终洗脱回收目标DNA。常用于去除小片段如接头二聚体/引物二聚体,或用于样本富集。
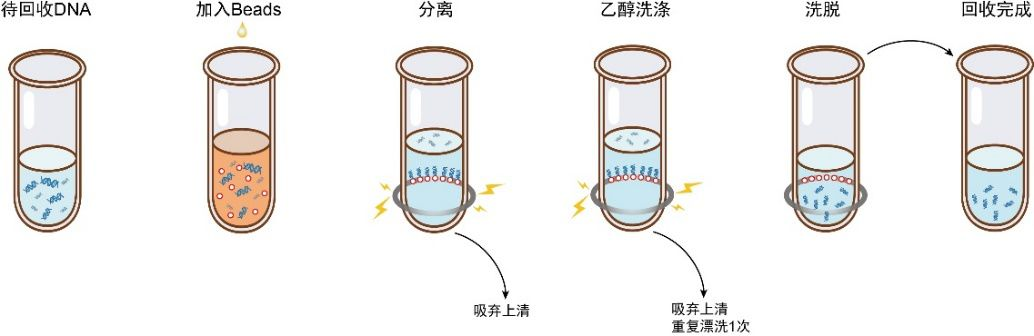
图4. DNA纯化流程示意图
DNA磁珠纯化过程中会有部分样本损失,回收效率可通过公式计算:回收效率 =(纯化后DNA质量 / Input DNA质量)× 100%。数据显示,翌圣DNA磁珠批次稳定性良好,回收效率与XP磁珠相当,是高性价比的替代产品。
表1. 磁珠回收效率计算
|
平行 |
样本 |
Input(ng) |
纯化(1.8×) |
||
|
纯化后(ng) |
回收率% |
平均回收率 |
|||
|
平行1 |
A-XP |
169.5 |
153.25 |
90.41% |
90.41% |
|
B-YS |
159.75 |
94.25% |
94.50% |
||
|
C-YS |
162 |
95.58% |
|||
|
D-YS |
158.75 |
93.66% |
|||
|
平行2 |
A-XP |
156 |
92.04% |
92.04% |
|
|
B-YS |
156.5 |
92.33% |
93.51% |
||
|
C-YS |
160 |
94.40% |
|||
|
D-YS |
159 |
93.81% |
|||
【注】:磁珠测试数据来源于上海某生物公司,表格中A为AMPure XP磁珠;B、C、D分别是翌圣磁珠三个不同批次。
DNA双轮分选(片筛)
二代测序要求NGS文库达到特定长度,片筛用于从片段化DNA中筛选目标片段。利用磁珠优先吸附大片段的特点,第一轮吸附大片段后弃磁珠留上清,目标片段在上清中。第二轮磁珠吸附目标片段,弃上清后洗脱回收目的片段。
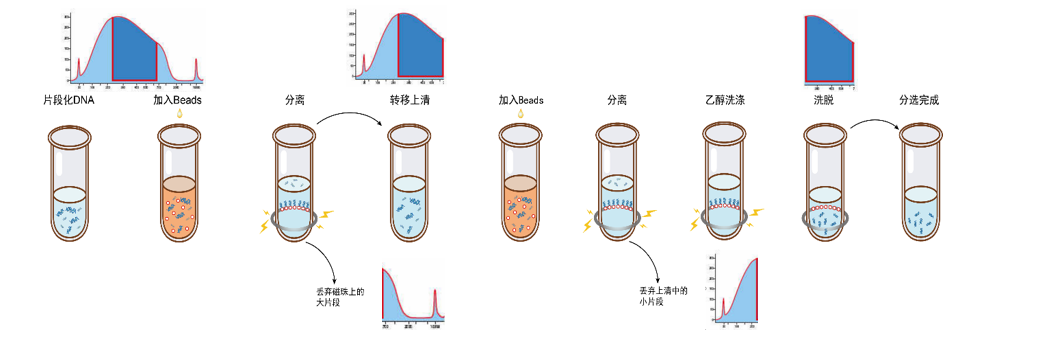
图5. DNA双轮分选流程示意图
分选精度评估不同磁珠投入比例下分选的片段大小,通常通过Agilent 2100仪器检测。
在特定磁珠比例下,不同样本的片段分布应集中于同一位置,理想的分选效果为顶部窄而圆润的独峰。不同厂家由于buffer差异,在特定磁珠比例下分布会有所不同,使用前需参照说明书确认目标片段的分选比例。数据显示,相同分选比例下,翌圣磁珠与进口XP磁珠的分选效果高度一致。
表2. 分选效率计算
|
样本 |
|
分选(0.65×/0.2×) |
||
|
Input(ng) |
分选后(ng) |
回收效率% |
平均回收率 |
|
|
A-XP |
276.44 |
55.2 |
19.97% |
19.97% |
|
B-YS |
||||
|
61.35 |
22.19% |
22.84% |
||
|
C-YS |
65.4 |
23.68% |
||
|
D-YS |
62.55 |
22.63% |
||
【注】:磁珠测试数据来源于上海某生物公司,表格中A为AMPure XP磁珠;B、C、D分别是翌圣磁珠三个不同批次。
Hieff NGS® DNA Selection Beads基于SPRI原理,结合优化的缓冲体系,适用于二代测序文库中的DNA片段分选和纯化。该产品兼容各品牌的建库试剂盒,片段回收效率和文库大小分布与XP磁珠相似。值得注意的是,翌圣磁珠的价格可低至3元/库,与进口XP磁珠达到3倍之差!
表3. Hieff NGS® 系列磁珠产品推荐
|
磁珠分类 |
产品名称 |
货号 |
规格 |
目录价(元) |
用途及应用场景 |
|
DNA磁珠 |
12601ES08 |
5 mL |
955 |
NGS DNA片段纯化与筛选 |
|
|
12601ES56 |
60 mL |
4165 |
|||
|
12601ES75 |
450 mL |
25885 |
|||
|
12600ES08 |
5 mL |
955 |
小片段纯化(50 bp以上) |
||
|
12600ES56 |
60 mL |
4165 |
|||
|
12600ES75 |
450 mL |
25885 |
|||
|
RNA磁珠 |
12602ES08 |
5 mL |
955 |
RNA文库构建 |
|
|
12602ES56 |
60 mL |
4165 |
|||
|
12602ES75 |
450 mL |
25885 |
|||
|
12629ES24 |
24 T |
375 |
mRNA分离纯化 |
||
|
12629ES96 |
96 T |
1495 |
