RT-qPCR需要注意的那些事,你都了解吗?
在RT-qPCR实验中不论是实验小白还是老司机,都会遇到各种不同的实验问题。解决问题不仅要浪费额外的样品和试剂,还要占用大量的时间一遍遍的重复和分析,真是被实验折磨得焦头烂额。那实验过程中应该注意哪些细节呢?小翌精心为大家总结了RT-qPCR实验的注意事项,希望助小伙伴们一臂之力。
RT-qPCR实验包括RNA提取与质量评估,逆转录和qPCR三大步骤,每个步骤都有很多注意事项,下面由小翌给您详细介绍。
RNA质量评估
在RT-qPCR实验中,RNA提取完成后,需要对RNA的质量进行评估,合格后才可进行后续实验。评估方法有分光光度计,琼脂糖凝胶电泳,Agilent 2100分析等,其中最常用的有分光光度计和琼脂糖凝胶电泳法检测。我们需要注意的是这两种方法需要搭配使用,才能完成对RNA浓度、纯度和完整度的检测分析,以保证RNA的质量。
分光光度计:
分光光度计主要用于测定RNA的浓度和纯度,但不能对RNA的完整度和基因组残留进行检测。其中,A260/280和A260/230是RNA纯度检测的重要参数,可根据其数值的波动,检测RNA的纯度:
1、1.9< A260/280< 2.1,说明RNA纯度较好;A260/280<1.9,表示RNA中可能有蛋白残留;A260/280>2.1,表示RNA可能有部分降解,可经琼脂糖凝胶电泳进一步确认。
2、2.0< A260/230< 2.2,说明RNA纯度较好;A260/230< 2.0,则说明RNA中可能有机试剂残留,如酚、乙醇或糖类等。
琼脂糖凝胶电泳:
琼脂糖凝胶电泳检测可以分析RNA的完整度,基因组和蛋白残留,但不能对RNA的浓度准确定量,也不能检测有机试剂的残留。以真核生物RNA模板为例:
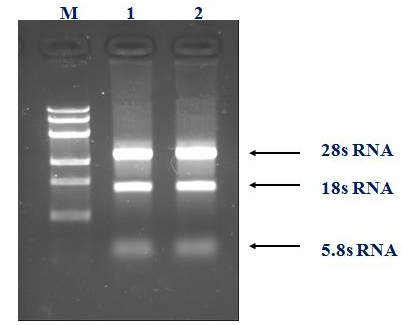
1、 将RNA进行琼脂糖凝胶电泳,若胶图上只有28sRNA、18sRNA和5.8sRNA三条单一的条带,说明提取的RNA完整度良好。如果出现拖带的现象,表示RNA部分降解。
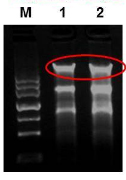
2、若胶孔和28sRNA条带之间出现单一明亮的条带,表示可能有基因组DNA残留。
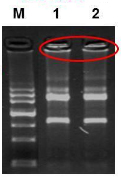
3、若胶孔内出现条带,说明可能有蛋白等大分子物质残留。
逆转录
RNA提取完成后,需要反转成cDNA才能进行后续实验,所以反转步骤是必不可少的。逆转录将从逆转录酶的选择和引物的选择进行介绍:
逆转录酶的选择:
常见代表性反转录酶有AMV RTase和MMLV RTase两大类:AMV RTase的RNase H活性强,合成长度短,合成量低,热稳定性好(42~55℃);MMLV RTase的RNase H活性弱,合成长度长,合成量高,热稳定性差(37~42℃)。
由于RNase H酶具有降解RNA模板的功能,所以在逆转录时应该优先选择RNase H活性弱的MMLV ,而且后期经过基因工程改造,MMLV热稳定性已达到质的飞跃。以Yeasen的Hifair® Ⅲ逆转录酶(11141)为例,该酶经基因工程改造,删除了RNase H活性,同时反应温度可达60℃,针对高GC及富含复杂二级结构的模板具有更高的反转录效率。
引物的选择:
通常RT primer可分为三类:oligo dT,随机引物和基因特异性引物。根据不同的实验需求选择适合的引物进行使用。
1、如果模板为真核生物来源,且后期cDNA用于常规PCR扩增,建议选择Oligo(dT);若后续实验仅用于qPCR,建议将Oligo(dT)与随机引物混合后使用,可提高反转录效率。
2、如果模板为原核生物来源,反转录请选用Random Primers 或者基因特异性引物。
荧光定量
荧光定量主要从定量方法的选择、引物设计原则、ROX的选择、反应体系的配置和反应条件的设置等分别进行阐述:
定量方法的选择:
定量方法分为相对定量和绝对定量。相对定量可用于检测某种处理方法对基因表达的影响,检测基因在不同时间的表达差异和比较基因在不同组织中的表达差异;绝对定量可对病毒中核酸的量进行检测等。大家在做实验时,一定要根据自己的实验选择合适的定量方法。
引物设计原则:
qPCR引物设计的好坏,直接关乎着扩增效率高低,产物特异性与否。所以正确设计出好的引物是qPCR成功的第一步。引物设计在满足常规引物设计的原则上还要注意以下原则:
1、 目的片段长度控制在100 ~ 300 bp;
2、跨外显子设计,避免基因组DNA的影响;
3、 设计的引物需要进行扩增效率的检测,扩增效率达标(90-110%)才可用于定量实验;
4、 引物浓度通常在0.1uM-1.0uM之间优化选择。
ROX的选择:
在定量反应过程中,ROX能够均一化校正仪器的光程差,移液误差或蒸发冷凝导致的体积差等,提高结果的重复性。但需要注意的是ROX的选择与仪器相关,如果qPCR仪有自动校正孔间差的功能,就不需要添加ROX,反之则需要添加ROX校正。小伙伴们在买试剂时一定要根据所用的仪器型号选择正确ROX,避免后期出错。
反应体系的配制:
反应体积优先推荐20ul和50ul。体系配制时要注意以下事项:
1、 反应体系需要在超净工作台中通风配制;每次实验都要用新的ddH2O;
2、每次实验都需要配制NTC来验证体系中是否存在污染,配制体系时每一对引物都需要做NTC;
3、如果想检测RNA模板是否有gDNA残留,可将每个样本都配制NRT进行检测;
4、配制体系时,一个样本建议至少做3个技术型重复;
5、模板为cDNA时,建议稀释5-10倍,减少反转录体系对qPCR实验的抑制作用,模板量最好进行梯度摸索,使CT值落在20-30之间最佳;
6、确定所需的反应数量,在反应数量的基础上增加5-10%,计算体积配置数量;
7、体系配制采用能预混则预混原则,混匀后离心并保证无气泡;
8、尽量选择进口且配套的耗材,如ABI仪器最好使用ABI封板膜,伯乐仪器使用配套的白色陶瓷板子。
反应条件的设定:
1、设置程序时要注意配体法的预变性为95℃,5min;抗体法的预变性为95℃,30s。;
2、选择两步法,可保证产物高特异,选择三步法可保证高效率扩增,小伙伴可根据自己的实验选择合适的程序;
3、上机时尽量避免使用最外面一圈的孔。
以上就是小翌对RT-qPCR注意事项的详细总结,希望能够对大家的实验有所帮助。小翌在这里提前祝大家中秋快乐,实验顺利。
相关推荐
|
产品名称 |
产品编号 |
规格 |
|
Hifair® Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus) |
11141ES10 |
100T |
|
11201ES03 |
5ml |
|
|
11202ES03 |
5ml |
|
|
11203ES03 |
5ml |
|
|
11195ES03 |
5ml |
|
|
Hieff UNICON® Power qPCR SYBR Green Master Mix (抗体法,Low Rox) |
11196ES03 |
5ml |
|
Hieff UNICON® Power qPCR SYBR Green Master Mix(抗体法,High Rox) |
11197ES03 |
5ml |
|
11198ES03 |
5ml |
|
|
11199ES03 |
5ml |
|
|
11200ES03 |
5ml |
