双荧光素酶报告基因检测原理及常见问题分析
萤火虫荧光素酶在氧气、ATP和镁离子同时存在的条件下,催化荧光素氧化,生成氧化荧光素,同时产生黄绿色光,波长540-600nm,一般检测时选用560nm。
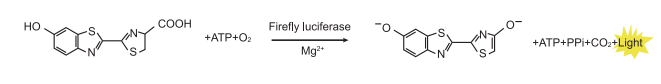
海肾荧光素酶只需要氧气就可以催化腔肠素氧化产生蓝光,波长460-540nm,一般检测时选用460nm。
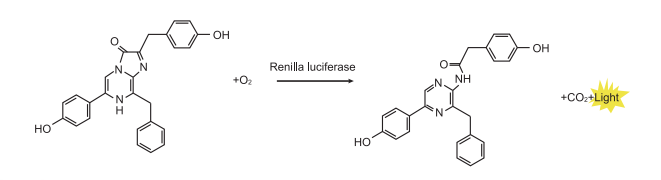
不同于绿色荧光蛋白(GFP)需要一定的光激发才能发光,且易淬灭;荧光素酶经过反应本身就可以自发荧光,并且只有在底物存在时才能发光。因此GFP只能用于标记或检测反应是否发生,而荧光素酶报告实验却能通过荧光值定量分析荧光素酶的表达水平。
荧光素酶作为一种理想的报告基因,可用于启动子研究、miRNA研究、信号转导通路研究等等。
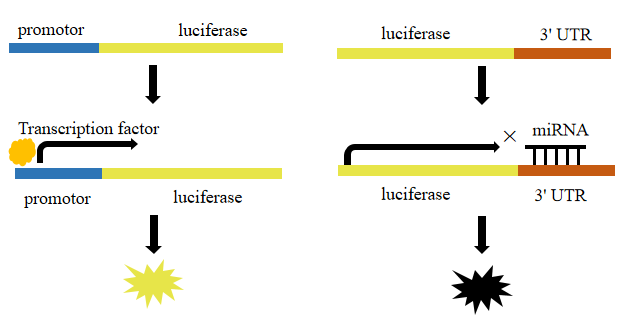
在报告基因的5'端加上待检测基因的启动子,就可以用来检测转录因子对启动子的作用,启动转录越多,那报告基因的表达量就越大,荧光值越高。如果在报告基因的3'端加上目的基因的3'UTR,就能用来检测miRNA对于目的基因的调控(抑制作用),报告基因表达越少,说明miRNA的作用就越强。
一般情况下,海肾荧光素酶基因作为内对照使用,将带有海肾荧光素酶基因的质粒与报告基因质粒共转染细胞;或是将两个报告基因构建到同一个质粒上,分别用不同的启动子启动其表达。计算结果时,将萤火虫荧光素酶的检测值比上海肾荧光素酶检测值,这样就可以减少内在变化因素对实验准确性的影响,使测试结果不受实验条件变化的干扰。
正是由于报告基因检测结果受多种因素影响,如载体状态、细胞状态、转染量、转染效率、裂解效率、加样精度、检测过程等,一旦某个细节处理不好,都可能导致实验失败或结果的不准确。小翌为此精心整理了大家实验过程中遇到的几类具有常见的问题和解决办法。
1.荧光值过高
荧光值过高可能会超出仪器检测范围,从而检测不到值,一般读数在5-6位之间较好。荧光值过高可通过以下方式尝试解决:
a. 减少质粒转染量;
b. 细胞样品裂解后,离心取上清后检测或对裂解产物进行稀释后检测。
注:不建议通过减少底物量来降低荧光值,需要保证底物的饱和来反映荧光素酶真实的表达水平,否则会造成检测结果出现大的偏差。
2.荧光值过低或无荧光值
荧光素酶的表达水平与启动子活性相关,正常表达水平下检测到的荧光值应在105数量级左右,若检测到的荧光值比较低或无荧光值,可从启动子活性、转染效率、检测过程这几方面进行考虑:
转染效率低
a. 优化转染实验条件,用较易转染的质粒做阳性对照(如转染过表达荧光蛋白质粒);
b. 确保转染DNA的质量,可通过酶切或琼脂糖凝胶电泳的方法对DNA质量进行鉴定;
c. 选择活性较高,处于指数分裂期的细胞进行转染。
启动子活性低或诱导失败
a. 转染后的细胞培养使用特异性诱导启动子的条件;
b. 优化细胞的培养条件,提高荧光素酶的表达量;
c. 更换强启动子(如SV40、CMV)。
注:海肾荧光素酶基因作为内对照,其表达应不受时期、部位、环境影响,因此常用组成型表达的TK启动子。
样品裂解效率低
a. 细胞培养时间不宜过长,12-36h内最好,长时间培养后,细胞可能会难裂解。
b. 加入的裂解液需足量,保证细胞能够充分裂解。
检测过程操作不规范
a. 选择合适的检测仪器,能够检测化学发光或者生物发光的仪器都适用于该实验;
b. 需加入足量底物,保证底物的饱和,否则会造成检测结果出现很大偏差;
c. 室温反应。反应时各个组分(细胞裂解产物,底物工作液等)都需要调整到室温;
d. 荧光素酶的半衰期一般约30min,加完底物后可立即检测,尽量在30min内完成。
底物氧化失效
a. 底物避光密封保存,萤火虫荧光素酶底物-20℃保存;海肾荧光素酶底物推荐-80℃保存;
b. 反应工作液建议现用现配。
3.复孔重复性差
报告基因检测实验受多种因素影响,因此同批次样品检测值也可能出现浮动。除了引入另一个报告基因作为内参照避免实验条件变化的干扰之外,一般还需设置3个或3个以上复孔。想要得到一个准确的结果,应尽可能减小复孔之间的差异性:
a. 细胞裂解后建议离心取上清,保证样本的均一性;
b. 保证加样的准确性,移液器需定期校准,确保移液精准;
注:荧光素酶报告基因实验的检测结果非常灵敏,复孔之间的数值有一定差异是正常的,一般认为在同一个数量级的差异是可以接受的。
以上就是大家平常给小翌反馈最多的几个问题,读完此文大家是否对这个实验有了更深一步的认识?如果您在实验中还遇到其他问题,欢迎留言或来电咨询。下面是福利时间!
1. 免费试用装申请点这里
2. 即日起购买翌圣双荧光素酶报告基因检测试剂盒,并向我们反馈实验数据,审核通过后即可领取相应奖品哦。
| 产品名称 | 货号 | 规格 |
| Dual Luciferase Reporter Gene Assay Kit 双荧光素酶报告基因检测试剂盒 |
11402ES60 | 100 T |
HB190620
