你测定的cDNA浓度到底准不准?
小翌最近被很多客户问到如下问题,做RT-qPCR实验时,逆转录之后测得的cDNA浓度低是什么原因?今天小翌就带您全面解答这个问题。
1. 影响cDNA浓度的因素
一般我们评估核酸模板的质量,需要从浓度、纯度及完整性三方面进行考量,但逆转录后的产物是一个混合体系,有cDNA、未完全逆转录的RNA、dNTP、残余的引物以及各种蛋白和盐离子等成分,会干扰cDNA的吸光度,因此不建议用逆转录后的cDNA来检测浓度与纯度。此外,260nm是核酸吸收峰最高的位置,在这个位置,1OD(optical density,光密度)的吸光度分别相当于50ng/μl的双链DNA,37ng/μl的单链DNA,40ng/μl的RNA,30ng/μl的寡核苷酸(dNTP)。就拿里面的dNTP来说,即使cDNA浓度一样,但dNTP也会严重干扰其测定结果。
为此我们专门进行了验证,可以进一步说明dNTP 投入量对cDNA浓度检测结果存在的影响。以小鼠肌肉组织RNA为模板,采用Yeasen逆转录试剂盒11121ES(dNTP 组分按 1μl / 1.5μl /2μl /2.5μl添加量的梯度检测)、T品牌、V品牌试剂分别进行逆转录实验,RNA 投入量为500ng,逆转录体系及程序分别按各自说明书进行。采用Nanodrop测定cDNA浓度,并取相同体积cDNA分别进行qPCR实验,结果证明:
-
不同品牌逆转录产品的cDNA浓度相差较大,但定量实验Ct值几乎一致。
-
逆转录体系中dNTP 投入量的多少会使cDNA浓度的测定结果产生较大差异,但最终Ct值几乎一致。
表1. Nanodrop定量结果统计表
|
产品 |
浓度(ng/μl) |
|
Yeasen 11121ES+ dNTP 1μl |
916.864/ 920.295 |
|
Yeasen 11121ES+ dNTP 1.5μl |
1247.707/ 1235.671 |
|
Yeasen 11121ES+ dNTP 2μl |
1603.601/ 1592.303 |
|
Yeasen 11121ES+ dNTP 2.5μl |
1784.639/ 1780.047 |
|
T品牌 |
756.293/ 759.956 |
|
V品牌 |
1055.075/ 1055.137 |
|
dNTP(10mM)1μl |
9477.6/9488.6 |
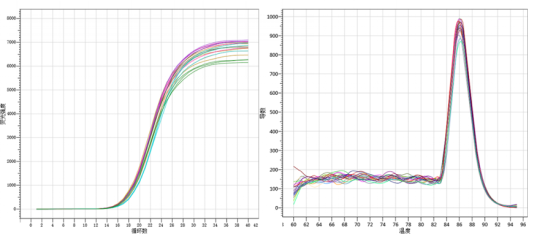
图1.qPCR检测结果△Ct<1,且 Ct 值与 Nanodrop 定量结果无线性关系
因此,cDNA浓度的测定值是不准确的,逆转录实验之后无需测定浓度。RT-qPCR是一个多步骤连贯实验,正是因为cDNA无法鉴定,只能通过后续qPCR实验才能呈现结果,那如何去尽可能保证可以得到一份高质量的cDNA,从而保证整个实验的顺利进行呢?
2. 如何获取高质量的cDNA
作为RT-qPCR实验的第一步,RNA的质量直接决定定量结果的准确性与可靠性。要获得一份高质量的RNA模板,可从以下几方面进行优化。
1) 样品处理与保存
新鲜采取的样本可进行液氮速冻或用一些特定的RNA样品储存液进行处理,能立即保护样品中的RNA,并灭活内源RNase。样品用液氮瞬间冻结之后,应储存在-80°C,不能进行解冻,否则将导致RNA的降解和损失。而用RNA样品储存液进行处理的样品,保存条件则相对宽泛,长期保存可置于-20°C以下,短期保存可置于4°C。
2) RNA提取
RNA的提取方式分为柱式提取和非柱式提取(如Trizol)。柱式提取法去除蛋白及其他杂质干净,提高了RNA的纯度,但非柱式提取的方法RNA的得率则相对较高。环境中的RNase几乎是无所不在,所以在整个RNA提取与后续逆转录过程中,用到的吸头、离心管、移液器、各种溶液、工作台等等,必须确保无RNase污染。除去传统的DEPC浸泡法,还能加以使用表面去污净化溶液如RNase喷雾清除剂来进行处理。
3) RNA储存
纯化的RNA应溶于无RNase的水中储存,储存温度在-20°C或以下。最好将核酸模板分装成小份保存以减少反复冻融。模板解冻完全后轻弹混匀后再使用。
4) RNA逆转录
①选择合适的逆转录引物
|
逆转录引物选择指南 |
||||
|
特征 |
优点 |
缺点 |
结合方式 |
|
|
Oligo (dT) |
1)12-20个T; 2)与真核生物mRNA的3’ Poly A尾配对。 |
可合成全长cDNA。
|
1)仅扩增有poly A尾的mRNA; 2)对模板质量要求高。 |
|
|
Random Primers |
1)6-9个碱基; 2)可随机识别模板并结合。 |
适合复杂结构和微量模板。 |
特异性低,小片段多。 |
|
|
基因特异性引物(GSP) |
识别特定模板序列。 |
特异性强,灵敏度高。 |
仅合成特定的序列,不适合研究同一个样本中多个基因。 |
|
②选择合适的逆转录酶
对于逆转录酶的选择,目前科研领域常用的逆转录酶主要有AMV, MMLV,以及基于这两种酶改造的其他逆转录酶。Yeasen Hifair酶经过分子改造后,缺失了MMLV原有的RNase H活性,避免了模板RNA的降解;同时具有更高的反应温度,针对一些高GC含量,以及富含复杂二级结构的RNA模板具有更强的逆转录效率。
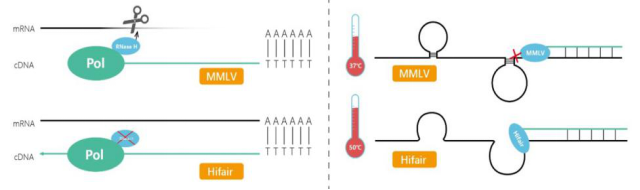
图2. Hifair酶缺失了RNase H活性,对复杂模板具有更强的逆转录效率
掌握了以上要点,终于不用纠结cDNA浓度了吧?
小翌在此给大家介绍下翌圣的逆转录相关产品。
翌圣逆转录产品选择指南
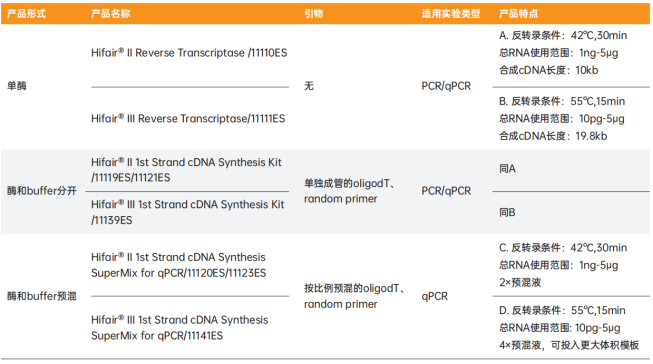
小翌强烈推荐Hifair® Ⅲ Reverse Transcriptase,该酶具有逆转录效率出色、延伸性能优越、RNA线性检测范围广等优势,助力您合成高质量的cDNA。
① 出色的逆转录效率,适合不同 GC 含量、不同表达丰度的基因
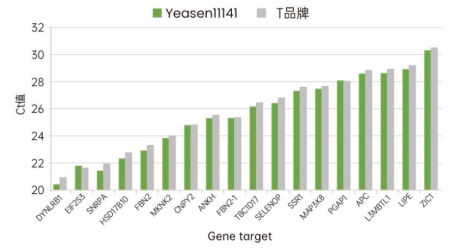
图3.以300ng 293T细胞的总RNA为模板, 使用11141ES、T品牌合成cDNA。取1μL cDNA为模板, 使用Hieff UNICON® Power qPCR 预混液 (Cat NO.11195ES)扩增20个不同GC含量(25-65%)、不同表达丰度的基因。
② 优越的延伸性能,可合成19.8kb的cDNA
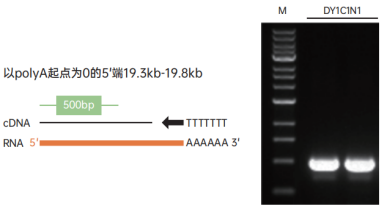
图4. 以500ng 293T细胞的总RNA为模板,oligodT为引物,使用11139ES合成cDNA。 取1μL cDNA为模板,使用Hieff® Canace Gold 高保真酶(Cat NO.10148ES)扩增DY1C1N1基因(19.9kb)的5’的500bp。M: 1kb DNA ladder。
③ 线性检测范围广,Total RNA 10pg-5μg
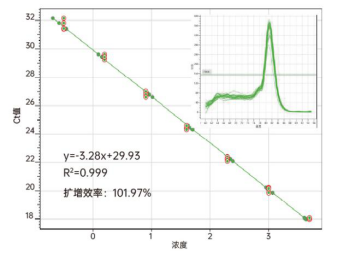
图5. 以10pg-5μg的293T细胞的总RNA为模板,使用11141ES合成cDNA。取1μL cDNA为模板,使用Hieff UNICON® Power qPCR 预混液 (Cat NO.11195ES)扩增PTTG1基因。
翌圣逆转录产品荣登过的高分杂志(部分)
1. Liu C X, Li X, Nan F, et al. Structure and degradation of circular RNAs regulate PKR activation in innate immunity[J]. Cell, 2019, 177(4): 865-880. e21.(IF31.398)
2. Fan H, Hong B, Luo Y, et al. The effect of whey protein on viral infection and replication of SARS-CoV-2 and pangolin coronavirus in vitro[J]. Signal transduction and targeted therapy, 2020, 5(1): 1-3.(IF13.493)
3. Zhou L, Hou B, Wang D, et al. Engineering Polymeric Prodrug Nanoplatform for Vaccinatio Immunotherapy of Cancer[J]. Nano Letters, 2020.(IF12.279)
4. Wang J., et al., The mycobacterial phosphatase PtpA regulates the expression of host genes and promotes cell proliferation[J]. Nat Commun. 2017 Aug 15;8(1):244.(IF 12.353)
5. Tao L, Yi Y, Chen Y, et al. RIP1 kinase activity promotes steatohepatitis through mediating cell death and inflammation in macrophages[J]. bioRxiv, 2020.( IF10.717)
点此申请试用装,数量有限,先到先得!
往期推荐
喜报 | 翌圣qPCR产品助力武大宋保亮团队荣登Nature杂志
HB201231