 10min ,get甲基化研究速成指南
10min ,get甲基化研究速成指南
什么是DNA甲基化
DNA甲基化(DNA methylation)是DNA化学修饰的一种形式,能够在不改变DNA序列的前提下改变遗传表现。DNA甲基化是指在DNA甲基化转移酶的作用下,在基因组CpG二核苷酸的胞嘧啶5'碳位共价键结合一个甲基基团。DNA甲基化的结果,一般是使甲基化位点的下游基因表达量变少。从而影响基因表达、染色质结构稳定性等多种生物学过程。近年来,随着高通量测序技术的发展,人们对于甲基化的研究越来越深入。
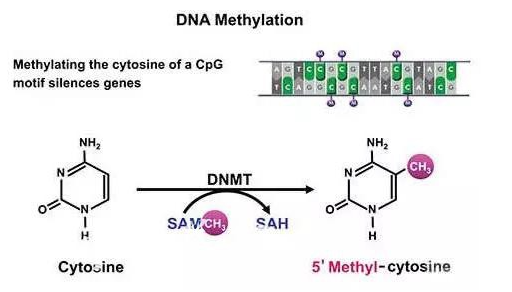
图1:DNA甲基化原理图
甲基化研究主要包括:
1. 甲基化检测技术的发展:包括基于传统测序、芯片等技术的甲基化检测方法,以及新兴的单分子测序及其组合技术。
2. 甲基化在基因表达、基因组结构和功能等方面的作用研究:通过整个基因组的甲基化水平分析,揭示甲基化在基因表达、基因间调控以及发育等多个生物学过程中的作用。
3. 甲基化与疾病关联的研究:研究甲基化在疾病发生、发展过程中的具体作用机制,探索基于甲基化的分子诊断和治疗方案。
甲基化研究在生物医学和生命科学领域具有重要的应用前景,可以为生物学研究提供新的思路和理论基础,也可以为临床疾病诊断及治疗提供新的方法和方向。
为什么研究DNA甲基化
DNA甲基化是最早发现的基因表观修饰方式之一,可能存在于所有高等生物中。DNA甲基化在维持细胞正常功能、传递基因组印记、胚胎发育、肿瘤发生等方面发挥重要作用,比如DNA甲基化能关闭调控细胞生长基因的功能,导致细胞坏死或过度增值;此外,DNA甲基化还能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。目前DNA甲基化已成为表观遗传学和表观基因组学的研究热点。
![]()
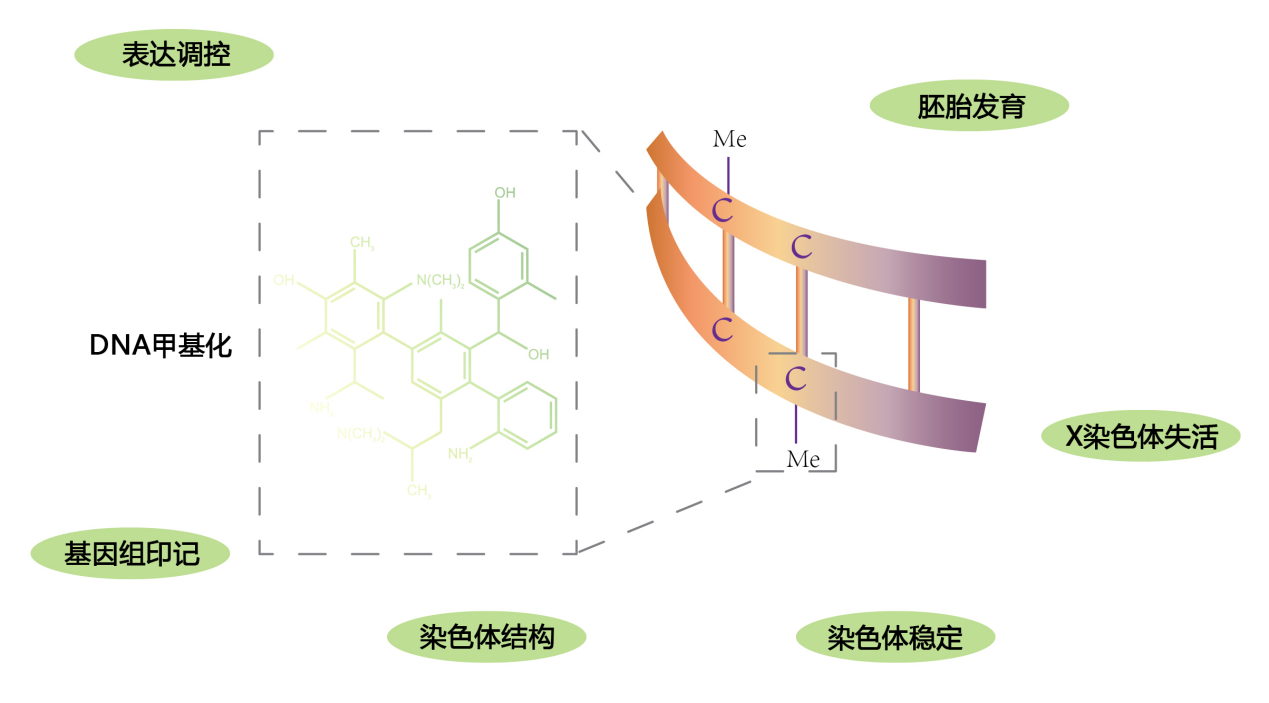
图2:DNA甲基化的应用
DNA甲基化与高通量测序
甲基化机制的发现,使DNA甲基化的研究受到了广泛关注,从医学领域扩展到动植物研究领域,同时在研究方法上也取得了很大突破。目前用于DNA甲基化检测的方法大致可分成两类:全基因组甲基化分析和特异位点甲基化检测。以上两类方法都是通过高通量测序来完成的,它不仅能够覆盖所有甲基化位点,还可以配合靶向技术检测低频甲基化信号,使我们能够从全基因组水平来分析5’甲基胞嘧啶及组蛋白修饰等事件,这就是所谓的“DNA甲基化测序”。

图3:甲基化DNA测序图
DNA甲基化建库
经过甲基化修饰的DNA序列是不会改变的,常规建库的测序不能检测到甲基化位点,因此需要在建库过程中对发生甲基化的位点进行标记区分。目前全基因组重亚硫酸氢盐测序(WGBS或BS-Seq,Whole Genome Bisulfate Sequencing)是甲基化测序的唯一准则,市场上的甲基化建库试剂盒也都是基于此原理研发出来的。
说到DNA甲基化建库,我们先来看一下常规的DNA建库流程,详情请参考——划重点!NGS中DNA建库方法全面解析
主要流程:DNA片段化——末端修复——A尾添加——接头连接——PCR扩增
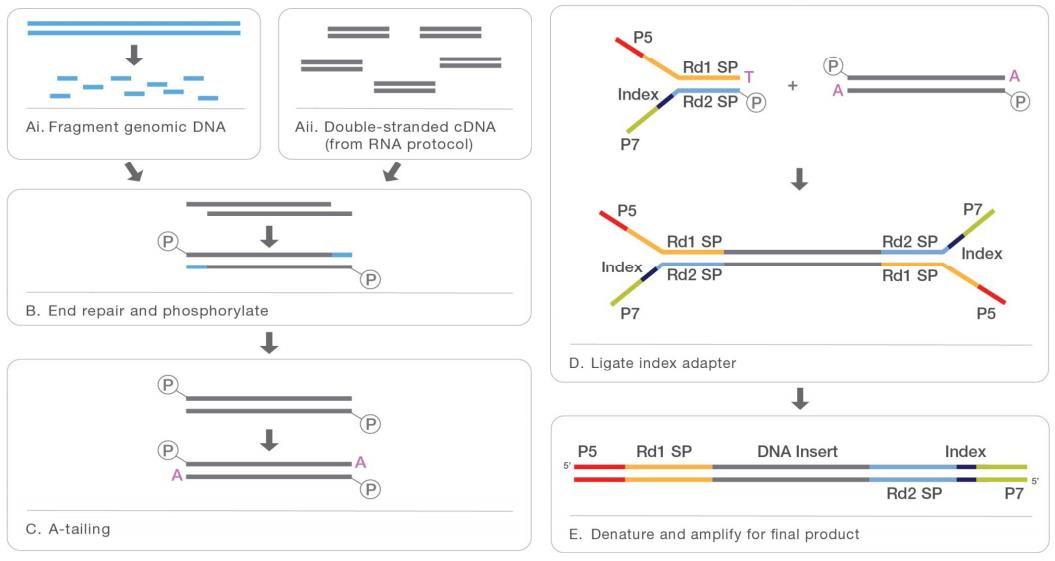
图4:DNA文库构建
与常规DNA建库相比,甲基化建库主要是在原有步骤的基础上增加一步重亚硫酸氢盐转化,对应原理如下:
重亚硫酸氢盐转化
在弱酸性条件下,亚硫酸氢根会结合到没有甲基化的C碱基的第6位,而甲基化了的C碱基不会和亚硫酸氢根发生反应。之后,用碱处理,结合了亚硫酸氢根的非甲基化的C会发生脱氨基,脱亚硫酸根,被转化成U碱基,甲基化的胞嘧啶保持不变,还是C。
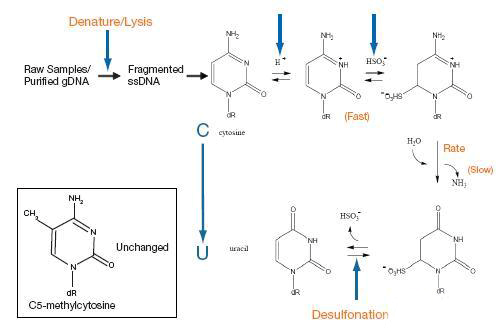
图5:亚硫酸氢盐转化原理图
经亚硫酸氢盐转化过的DNA,再经过PCR,PCR新合成出来的链,对应U碱基的位置就会被替换成了“T”。在接下来的测序过程中,测到的也是T碱基。最后,我们只需看一个位置是“C”,还是“T”,就可以区分该位点是否被甲基化 。
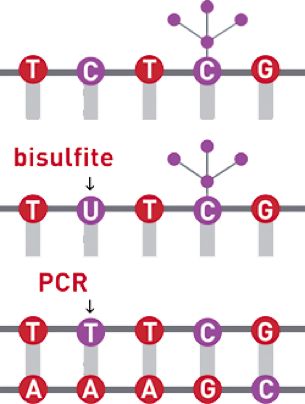
![]()
图6:DNA甲基化测序对应碱基
目前对应的甲基化建库方法主要分为以下两类:
I:选择甲基化处理过的特异性接头,在文库构建好后用重亚硫酸氢盐转化,然后上机测序
DNA片段化——末端修复——A尾添加——特殊接头连接——PCR扩增——重亚硫酸氢盐转化
II:DNA片段化后直接用重亚硫酸氢盐转化,然后按照正常的DNA 建库操作。
DNA片段化——重亚硫酸氢盐转化——末端修复——A尾添加——接头连接——PCR扩增
两种方法都有各自对应的优缺点,主要如下:
|
方法I |
方法II |
|
|
优点 |
PCR循环数较少,文库不均一程度较低,PCR bias较少。 |
建库的丰富程度比较高 |
|
缺点 |
在用亚硫酸氢盐处理DNA文库的时侯,90%以上的DNA链会断掉。文库的丰富度就会损失90%以上。 |
较多的PCR循环,产物的扩增均一性是不太好的,PCR bias会比较大。 |
温馨提示:
1.设置内参:在甲基化文库建程当中,亚硫酸氢盐对未甲基化的C的转化效率并不是100%,一般是在99%左右。为了对实验的转化效率进行质量控制。建议在转化实验当中加入内参对照品。一般情况下,实验当中是加入1%的完全没有甲基化的λ DNA做内参,主要是甲基化酶缺陷型的大肠杆菌,所生产出来的完全没有被甲基化的λ(噬菌体)DNA,或者pUC19(质粒)DNA做内参。
2.浓度测定:经过重亚硫酸盐处理后的基因组DNA,由于其中非甲基化的“C”会转化为“U”,所以回收后的DNA会是一种“A”,“T”和“U”占大部分的核酸分子,而且当初的碱基配对形式也不复存在,取而代之的是主要以单链形式和非特异性配对形式存在的特殊核酸形态,这种形态的核酸在OD260处的吸光值与RNA更为相似,所以纯化后基因组DNA的OD260值为1时,则相当于大约40 μg/ml的核酸浓度。另外,基于处理后核酸状态的特殊性,其OD230测值会出现异常现象,可能导致OD260/OD230比值不稳定,这种情况不会影响后续的PCR反应。
3.上机测序:为了弥补甲基化文库的碱基不平衡性,一般情况下,在上机过程当中,掺入大比例的基因组文库,或者PhiX文库,来补充比较多的C碱基,一般会掺30%的PhiX文库、或者基因组文库。


