纯干货!显色示踪荧光定量相对定量操作解析
实验材料:
1.cDNA样本:通过上游反转录反应得到的cDNA。
2.荧光定量试剂:Hieff UNICON® ColorGPS qPCR SYBR Green Master Mix (No/Low/High Rox)。
3.其他试剂:RNase-free H2O、相关基因上下游引物(储存浓度10 μM)。
4.设备与耗材:移液器、qPCR仪、冰盒、离心机、RNase-free八连排、RNase-free离心管。
实验步骤:
试剂&样本前期准备
试剂解冻和混匀
-
从冰箱中取出:
从-20℃冰箱中取出含酶试剂,立即放入冰盒中(冰上操作);
避免将试剂直接放在室温下解冻,以免温度波动影响酶的活性。
-
缓慢解冻:
让试剂在冰上自然解冻,通常需要5-10分钟;
如果需要快速解冻,可以将试剂握在手中轻轻摇晃,但不要过度加热。
-
轻轻颠倒混匀:
解冻后,将试剂管轻轻上下颠倒几次,使试剂充分混匀;
避免剧烈震荡或涡旋混匀,以免破坏酶的活性。
-
低速离心:
将试剂管短暂离心(5-10秒,1000 rpm左右),使管壁和管盖上的液体集中到管底;
离心后再次轻轻混匀,确保试剂均匀分布;
混匀后的试剂应继续放在冰上,避免长时间暴露在室温下。
Tips:混匀时尽量避免产生气泡,气泡可能会影响酶的活性或实验结果的准确性。
模板稀释(若需要)
稀释步骤
-
若需追踪模板,按以下步骤稀释:
取1 μL 10×Dilution Buffer + 9 μL无菌超纯水 → 配制1×Dilution Buffer;
用1×Dilution Buffer稀释cDNA至目标浓度(建议稀释至Ct值20-30的范围内)。
-
若无需追踪模板,直接用无菌超纯水稀释cDNA或者直接使用cDNA原液。
荧光定量PCR反应体系配制
常见的荧光定量仪器为96孔反应,大体分为12列×8行。举例说明:
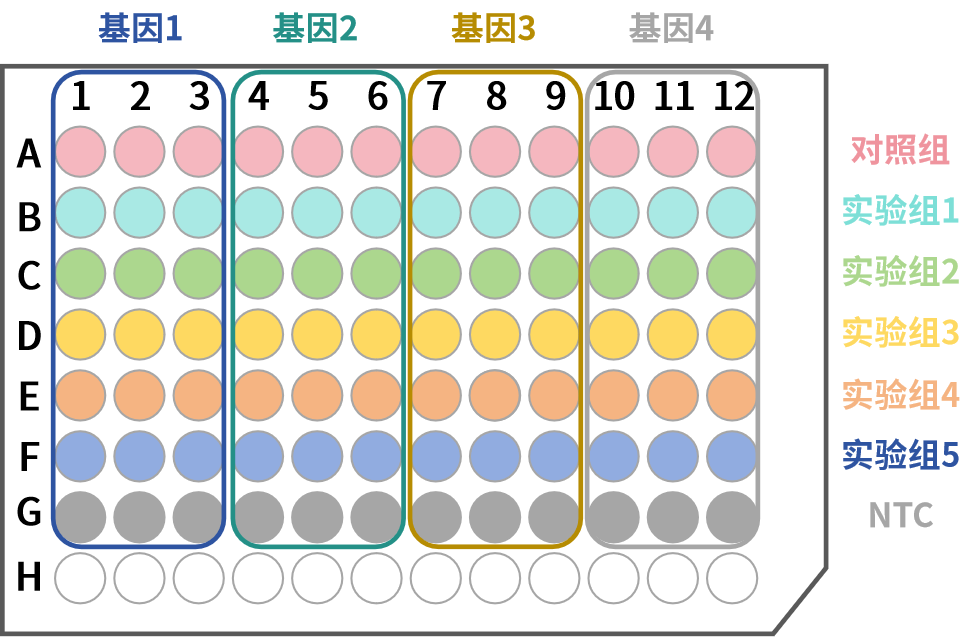
备注说明:
-
相对定量分析基因表达情况时,为排除样本和操作的影响,对数据进行归一化,需要有内参基因,例如GAPDH、β-actin等等。
-
技术重复通常建议设置3孔,为保证后续取平均值或剔除异常值。当然根据自己的需求进行调整,设置2孔重复或者4孔重复均可。
-
依据MIQE准则,NTC(阴性对照)建议设置,一方面用于污染风险判断,另一方面其也是一套实时荧光定量 PCR (qPCR) 实验设计及数据报告实践指南以及与发文共享实验信息的标准。
荧光定量PCR体系(大体系配制减少误差)
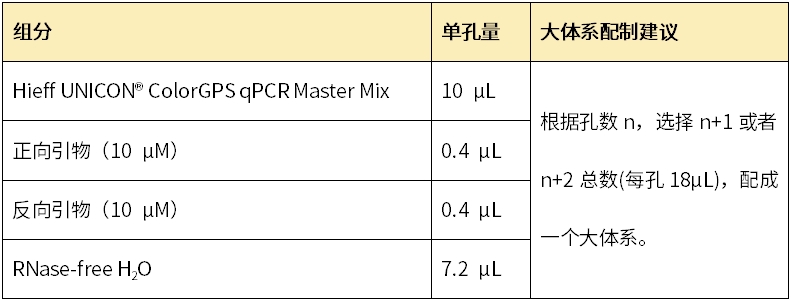
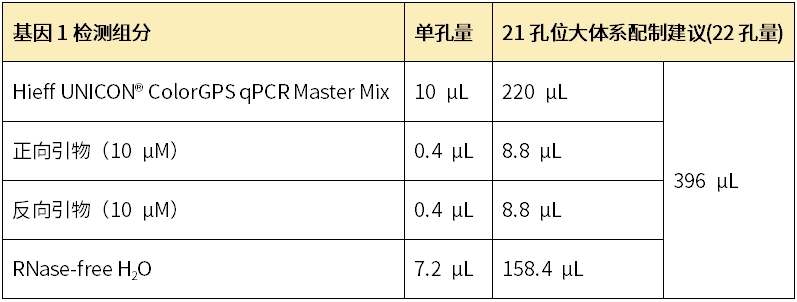
以上述投入2μL cDNA模板检测不同样本基因1为例:
将上述溶液依次加好后,将管盖盖严,用手轻弹管壁,使各组分充分混匀,再放入小型离心机,短暂离心1-2s,再次轻弹管壁(防止有气泡),瞬间离心(防止部分溶液沾到管壁上)并置于冰/冰板上。
备注:如使用显踪剂建议模板投入体积控制在2-5 μL,以保证显踪效果,如使用cDNA母液建议投入体积控制在2 μL(反应体系的1/10)以内防止影响扩增效果。
-
按照上机仪器选取对应耗材(八联排或96孔板)。
-
在对应耗材中按照布板依次分装18μL/孔步骤1)配置的大体系Mix。
-
在每个孔中加入2 μL对应模板。

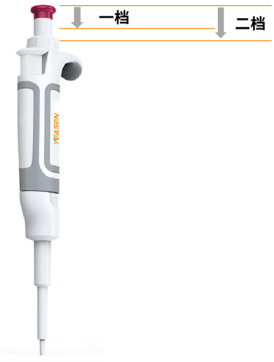
移液枪加样Tips(吸一排二):
-
吸取液体:缓慢、平稳地按下按钮至第一档(不是按到底),然后将吸头浸入液面下,然后缓慢、平稳地松开档位至原位来吸取液体。注意不要让吸头接触到容器的边缘或底部,以防止污染。
-
液体排出:将吸头对准接收容器,然后缓慢、平稳地按下按钮至第二档(按到底)以排出液体。确保所有的液体都被排出。
完成加样后,将管盖盖严,用手轻弹管壁,使各组分充分混匀,再放入小型离心机,短暂离心1-2s,再次轻弹管壁(防止有气泡),瞬间离心(防止部分溶液沾到管壁上)确保无气泡后置于洁净的96孔PCR管架。
备注:注意观察每一枪是否吸到了气泡,若出现气泡吸取则会导致实验数据出现较大偏差。
荧光定量PCR上机运行
上机前,仔细检查管子,确保正上方管盖、管身没有记号笔染料,管内无气泡、管壁无液体。
若采用常规程序,则进行以下设置:
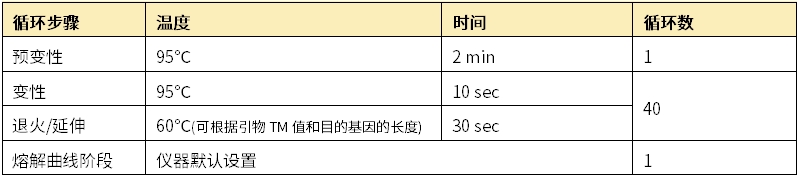
备注:
不同荧光定量qPCR试剂核心的酶和Buffer组成都存在差异,对应说明书上的程序是该产品大多数情况下的最适反应条件,建议按照说明书的程序进行仪器设置,减少因用其他程序带来的数据偏差;
熔解曲线程序可选用仪器默认程序。
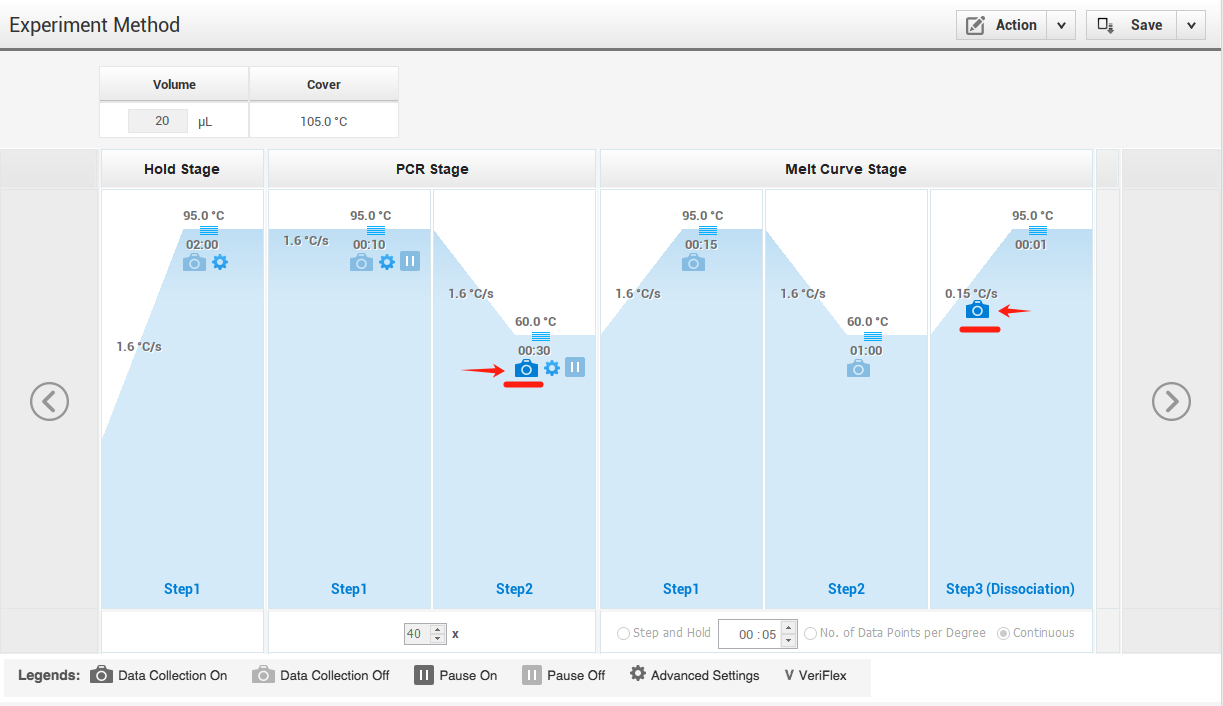
备注:以ABI Q5常规程序为例,在进行程序设置时,确保在退火/延伸阶段和熔解曲线的升温阶段打开数据信号收集开关。
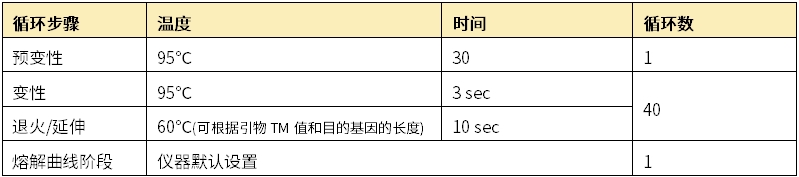
若采用快速程序,需确认仪器本身是否可以快速升降温,运行快速程序。以下以ABI Q5为例:
结果判定
-
观察熔解曲线峰是否单一。
-
初步判断复孔间Ct值差距是否<0.5,或者进一步计算复孔间CT值STD是否<0.2。
-
内参基因Ct值尽量在14-25之内,不要过小也不要过大。
数据分析
下机得到的Excel数据处理如下:
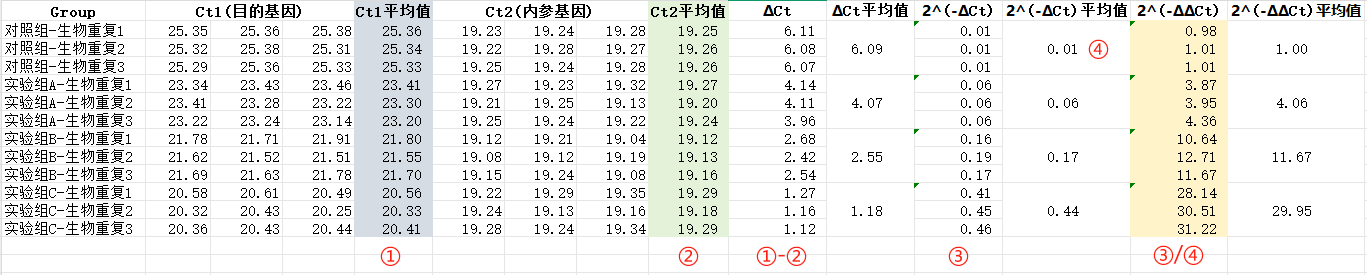
图示说明:
④:对照组校正后的数值;
③/④:每个小组校正后的数值比上对照组校正后的数值;
意图表上的数据在excel中采用了保留2位小数的形式,实际计算时不可忽略小数点后的所有数字,减少按数字的动作,活用Excel。
注意事项
1、引物设计好坏对于最终实验的成功和实验结果都会有一定的影响,可参考干货软文,解锁更多引物设计宝藏。
2、长时间放置的引物,建议尝试先用预实验(跟着其他实验或人带上几孔测测看),避免直接进行大规模正式实验,从而造成不必要的风险损失。
产品特别推荐:
|
方法 |
分类 |
产品名称 |
货号 |
|
RNA提取 |
同Trizol提取 |
10606ES |
|
|
免氯仿升级版 |
19202ES |
||
|
动物组织/细胞总RNA提取,避开有毒试剂,最快15 min完成 |
19221ES |
||
|
反转录 |
5 min高效高产反转 预混液(含gDNA去除) |
Hifair® AdvanceFast 1st Strand cDNA Synthesis SuperMix for qPCR (DNA digester plus) |
11155ES |
|
5 min一步gDNA去除&反转录预混液(下游应用qPCR) |
Hifair® AdvanceFast One-step RT-gDNA Digestion SuperMix for qPCR |
11151ES |
|
|
5 min快速反转,最长可满足14 kb cDNA合成,含gDNA去除(下游应用PCR/qPCR) |
Hifair® AdvanceFast 1st Strand cDNA Synthesis Kit |
11149/11150ES |
|
|
高质量第一链cDNA合成预混液,含gDNA去除(下游应用qPCR) |
Hifair® III 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus) |
11141ES |
|
|
qPCR染料法 |
高灵敏显色示踪荧光定量预混液(染料法) |
11188ES |
|
|
11189ES |
|||
|
Hieff UNICON® ColorGPS qPCR SYBR Green Master Mix (High Rox) |
11190ES |
||
|
高特异高荧光值定量预混液(染料法) |
11185ES |
||
|
高灵敏通用型定量预混液(染料法) |
11184ES |


