上新 | 中外法规药典内毒素检测新趋势-重组C因子法
内毒素的概念
已知,凡是能造成生物机体体温上升的物质均可称为热原(Pyrogen),其来源可能多样化。而细菌内毒素(Endotoxin)是热原的一种,它是细菌性感染的一个重要致病因素。
内毒素是革兰氏阴性菌菌体中存在的毒性物质总称,为多种革兰氏阴性菌细胞壁上的特有结构。细菌内毒素主要由磷脂、脂蛋白和脂多糖(LPS)组成,其中脂多糖(LPS)是天然或实验室制备的内毒素复合物的生物活性部分,发挥毒性作用的是类脂质A(Lipid A)。不同革兰氏阴性菌的脂质A结构基本相似,所以由此类细菌引起的感染导致的毒性效应大致相同,主要表现为发热、微循环障碍、内毒素休克及播散性血管内凝血等。细菌在存活状态时不会释放内毒素,但当细菌死亡裂解或者自溶后,内毒素会被大量释放出来。

图1.革兰氏阴性菌结构图
细菌内毒素耐热性和化学稳定性很强,一般的方法很难将其去除或灭活,如:常规高压灭菌法也不能将内毒素彻底清除,一般的化学药品也不会影响细菌内毒素的活性,只有强酸、强碱或强氧化剂可以破坏其结构。但内毒素具有水溶性,生产中可用无热原水冲洗以除去热原;其还具有被吸附性,可用活性碳将其吸附。
细菌内毒素是目前最危险和最常见的致热污染物之一,主要原因为:它在自然界中无处不在(革兰氏阴性菌即使在干净的水中也能繁殖)、毒性强、在极端条件下也很稳定、生产过程中很容易引入。对于日常的生命科学实验,使用细菌制备的质粒DNA和重组蛋白中都会有内毒素的残留,而且很难去除干净,进而对后续实验带来潜在毒性影响。内毒素的主要成分脂多糖有强烈的免疫活性和细胞毒性并产生复杂的细胞生物学效应,因此大多数情况下会明显干扰并产生不可预测的实验结果。对生物系统,当人(或动物)体血液系统的输入液中混入微量的细菌内毒素时,可激活组织内的炎性细胞和炎症因子,导致机体发热并产生全身性炎症反应,在很短时间内将会使人产生昏迷和高烧,若不及时抢救,很可能危及生命。
因此,无论是用于生命科学研究的可能含有内毒素的相关试剂,还是用于人和动物预防或治疗的化学药品、抗生素、生物制品等的原辅料、中间品和放行产品均需要进行内毒素检测,以确保有效性和安全性。
内毒素检测及法规监管要求
从20世纪开始,内毒素检测方法相继出现。
1942年,美国药典首先收载家兔法检测热原(RPT法)。该方法可以检测所有类型的热原物质;但有其缺点,即动物个体差异大导致检测灵敏度低,对于毒性大的药物如放射性药物或肿瘤抑制剂等无法进行检测,是定性而非定量方法,不能用于药品生产过程中的质量控制。
1980年,FDA发布用鲎试剂来检测人用和兽用注射药成品的内毒素;同年,《美国药典》收载细菌内毒素检测法,但在药典各品种正文中未涉及。
1995年,美国药典23版1至7增补本除了经典的凝胶法(LAL)外,还收载了动态浊度法、动态显色法、终点显色法。
2005年版《中国药典》也有规定热原检查采用家兔法,细菌内毒素检查采用鲎试剂法。鲎试剂法具有易操作、灵敏度高、可用于内毒素定量检测等优点,但也有其不便之处,如:鲎血批次间有差异,对革兰氏阴性菌以外的内毒素不灵敏,易受β-葡聚糖(β-Glucans)影响而产生假阳性,鲎受到动物保护,无法大批量供应。
鉴于上述情况,国内外药典法规也提出了一些新的内毒素检测方法。如:2020版《中国药典》(四部)9251章节中提到可以采用重组C因子法检测细菌内毒素(C因子是鲎试剂中对细菌内毒素敏感的蛋白,能够选择性识别内毒素)。美国药典(USP)专家委员会也已于2024年7月26日批准将USP<86>Bacterial Endotoxins Test Using Recombinant Reagents纳入《美国药典-国家处方集》,USP<86>章节于2024年11月发布,并于2025年5月正式生效。重组C因子法(rFc)通过重组方法产生C因子,具有:C因子来源稳定,受批次影响小;操作简单快速;更强的抗干扰能力(不受β-glucans影响);专属性好等优点。该方法也有其缺点,主要为来源于不同品质鲎血蛋白序列的重组蛋白对内毒素的反应性可能不同。
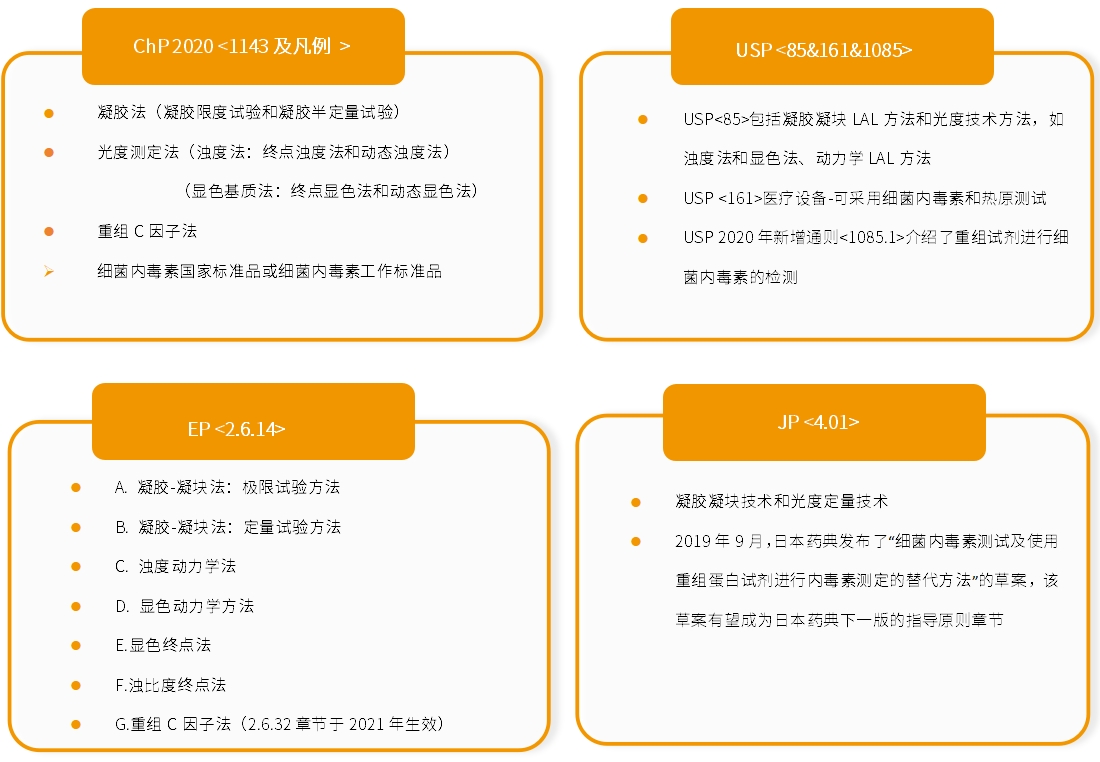
图2.中外法规里列举的内毒素检测方法
重组C因子内毒素检测方法
2020版《中国药典》(三部)针对细菌内毒素检测,收录了包括凝胶法和光度法在内的共6种细菌内毒素检查方法。
凝胶法和光度法等都需要从海洋节肢动物鲎中取鲎血作为原料,而鲎目前已呈濒危现状,亟需寻求替代方法。2020版《中国药典》(四部)9251章节中提到可以采用重组C因子法检测细菌内毒素。此外,美国、欧洲和日本药典也都提到可以采用重组C因子法检测细菌内毒素。
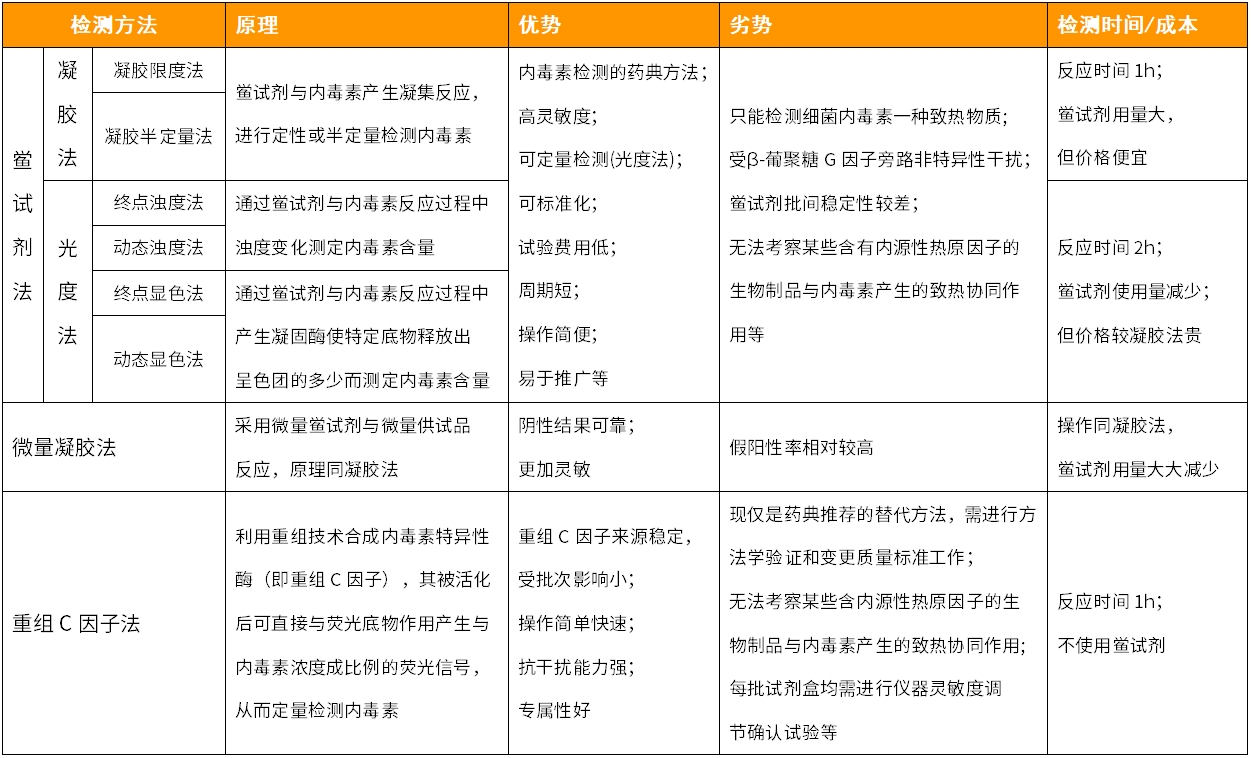
表1.各种内毒素检测方法介绍
目前,行业内对于内毒素的检测,虽然仍以鲎试剂方法为主,但也逐渐接受重组C因子的检测方法。为此,翌圣生物自主研发了重组C因子内毒素检测试剂盒。
本试剂盒通过基因重组的方式表达C因子,然后重组C因子被待测样本中的细菌内毒素激活,进而酶切水解荧光底物,产生与内毒素浓度成比例的荧光信号,根据荧光信号值检测内毒素含量。本试剂盒可以用于人类疾病治疗的注射药物(如化学药品、抗生素、生物制品等)和医疗器械(包括透析液、植入式器械等)的原辅料、研发和生产工艺过程以及商业化进程中的内毒素检测。
产品特点
-
安全稳定:合成试剂,不依赖动物源性成分,具有更高的批间一致性、安全性及可持续性;
-
强特异性:重组技术消除了鲎试剂中β-1,3-葡聚糖对检测结果的干扰,提高特异性和准确性;
-
高灵敏度:检测范围0.005-5EU/mL,定量下限(LLOQ)低至0.005EU/mL;
-
高精密度:批内重复性高CV<10%,批间差异小即中间精密度CV<15%;
-
快速便捷:仅需1h即可完成检测;
-
验证完善:参考ICH Q2(R2)分析方法验证指导原则,可提供完善的验证报告。
实验数据
试剂盒检测范围为0.005~5EU/mL,R2=0.9968,各浓度检测值CV≤10%。
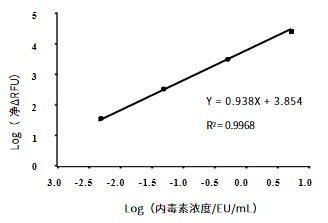
图3.重组C因子内毒素检测试剂盒标准曲线
该重组C因子内毒素检测试剂盒不受鲎试剂中β葡聚糖的干扰,避免了因β-葡聚糖引起的假阳性/结果不准确情况。
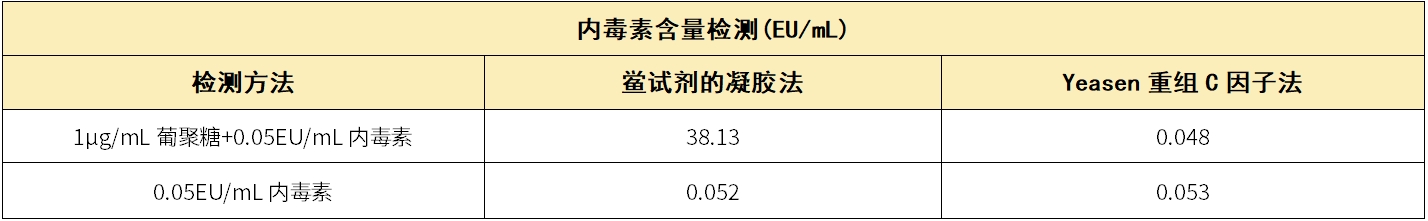
表2.不同内毒素检测方法数据对比
产品信息
|
类别 |
产品 |
货号 |
品名 |
规格 |
|
重组C因子法 内毒素检测 |
重组C因子试剂盒 |
36723ES |
Recombinant Factor C Endotoxin Detection Kit 重组C因子内毒素检测试剂盒 |
48 T/96 T |
|
动态浊度法 内毒素检测 |
动态浊度法 内毒素试剂 |
60401ES |
Kinetic Turbidimetric LAL Assays 动态浊度法内毒素检测鲎试剂 |
17 T |
|
内毒素去除 |
内毒素去除试剂盒 |
60404ES |
Endotoxin Removal Kit 内毒素去除试剂盒 |
1 Kit |
