试用!GMP级细胞因子重组人IL-3和人bFGF重磅上市!
前 言
以免疫细胞和干细胞为代表的细胞疗法,在越来越多种疾病的临床应用中显示出有效的作用,因其高度精准化和个性化的优势,已成为未来人类医学发展的热门方向。干细胞和免疫细胞治疗已被写入我国《“十四五”医药工业发展规划指南》。目前越来越多的人开始关注细胞治疗领域。
几乎所有的细胞治疗都有一个共同点,都需要使用细胞因子来诱导细胞增殖或分化。细胞因子是细胞治疗药物生产的关键原材料。为了能够获得高质量和性能稳定的免疫细胞和干细胞,确保治疗的安全性,对添加的原料必须有严格的质量要求,细胞疗法研发人员通常选用GMP级细胞因子。GMP级别细胞因子,对于药物的安全性、有效性、稳定性和药物的申报上市至关重要。
什么是GMP级细胞因子?
GMP级别细胞因子是指在生产过程中按照GMP标准进行,有严格的质量管理体系和规范的质量保证管理,最大限度的降低生产过程中的差异性和不确定性,确保产品的高质量。GMP级别细胞因子与重组药物不同,不能直接用于疾病治疗,可用于细胞治疗的辅助原料,且在形成终产品之前被去除,生产过程不经过药监局批准,但是在生产过程中严格遵守GMP要求。与科研级细胞因子相比,GMP级细胞因子具有更多的质量保证文件、可追溯性文件和质量控制测试。
细胞因子类型众多,包括生长因子(GF)、白细胞介素(IL)、干扰素(IFN)、集落刺激因子(CSF)、肿瘤坏死因子(TNF)、转化生长因子-β家族、趋化因子等。不同细胞因子对细胞生长及分化过程起着不同的调节作用,一些细胞因子能够诱导未成熟或不成熟的细胞向特定方向分化,形成具有特定功能的细胞类型,另一些细胞因子可能起到促进增殖、调控基因表达、维持分化状态等作用。
GMP级细胞因子相关法规
《中国药典》三部中“生物制品生产用原材料及辅料质量控制规程”
细胞因子等物料,归属于第3级中风险原材料。此类原材料供应商需提供出厂检验报告(CoA);企业需要制定此类物料的质检标准,并按照企业内控质检标准进行全检,并需要按照一定的频率对供应商进行审计。
国家药监局综合司发布《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》-2022年1月
第二十七条把细胞因子、生长因子列举为“关键物料”,要求企业应当对物料进行风险评估,对关键物料应开展入厂检验,并可根据特定风险,考虑建立降低风险的其他措施(如加强质量控制等)。
《细胞治疗产品研究与评价技术指导原则(试行)》-2017年12月
《免疫细胞治疗产品药学研究与评价技术指导原则》(试行)-2022年5月
原材料的使用应参考《中国药典》“生物制品生产用原材料及辅料的质量控制规程”,尽量使用质量标准级别高,风险级别低的原材料,确保其安全性和适用性。
具体说明原材料的来源、组分、功能、使用阶段、质量标准等,提供相关的文件(如来源证明、检验报告书(COA)、说明书、无TSE/BSE声明等)证明其符合拟定标准,适用于其预期用途,生产过程参照GMP相关原则和要求。原材料生产过程中尽量避免使用潜在致敏性材料,如β-内酰胺类抗生素(如青霉素),评估TSE/BSE安全性风险。
《人源干细胞产品药学研究与评价技术指导原则(试行)》-2023年4月
美国药典Chapter <92> 用于细胞治疗产品生产的生长因子和细胞因子
美国药典USP <1043>用于细胞、基因和组织工程产品的辅助材料
欧洲药典EP 5.2.12 用于细胞和基因治疗药物产品生产的生物来源的原料
(1)在一个合适的质量管理体系和生产设施中生产,严格无菌生产工艺,考虑添加剂(抗生素)的影响;原材料一般质量要求包括:鉴别、纯度、生物活性;杂质(残留HCP/DNA);微生物;病毒污染物;支原体;水分;含量;生物活性。
(2)原料是无菌的,并在无菌条件下生产和/或进行终端灭菌,除非另有说明。如果原料不是无菌的,必须知道微生物污染的水平。
ISO/TS 20399-1:2018生物技术-细胞治疗产品生产过程中存在的辅助材料
(1)生产过程中应对病毒进行去除或灭活。
(2) 确保辅助材料在与来源相关的动物疾病(例如,BSE/TSE)方面是安全的。
(3)对辅助材料进行特性测试并建立质量标准(如,鉴定、纯度、功能性、病毒污染和动物来源等)
YEASEN GMP质量管理体系
YEASEN致力于开发高质量的,应用于干细胞治疗药物临床阶段的相关试剂,在拥有GMP级别质量管理体系平台的基础上,结合细胞治疗药物生产规范,以更严格的质量管理和放行检测标准,成功开发了一系列高品质的GMP级别细胞因子,如IL-3和bFGF。

质量控制放行标准
-
细胞活性:Human IL-3: >1.7 x 106 IU/mg;
-
Human bFGF: >5.0x 106 IU/mg;
-
纯度:>95%;
-
内毒素:<10 EU/mg;
-
宿主DNA残留:< 20 ng/mg;
-
宿主蛋白残留:< 0.5 ng/ug;
-
无菌检测:阴性;
-
支原体检测:阴性;
-
外源病毒检测:阴性;
-
高批间一致性;
-
全面的稳定性数据支持(加速,冻融稳定性验证)。
2000平超洁净生产基地
YEASEN拥有2000平方米的GMP级蛋白表达纯化车间,为细胞培养提供高活性、高纯度、低内毒素GMP级生长因子。按照ISO13485质量体系管理,通过全封闭式超洁净生产工艺制造的细胞因子,保证了细胞因子的洁净度和稳定性。

YEASEN GMP级细胞因子生产环境(经ISO认证的洁净环境)
GMP级细胞因子产品特点
产品优势
-
无动物源性:无动物病毒、无致病物质、无外源因子污染,安全性高。
-
质量稳定性:可保证连续稳定的批量生产,批间差异小。
-
合规性:生产设备和生产环境符合相关法规要求,符合GMP指导原则。
-
质量文件完整:按客户需求,可提供相关法规支持文件。
-
药典标准放行。
-
E.coli来源,风险更低。
产品验证数据
1.高纯度
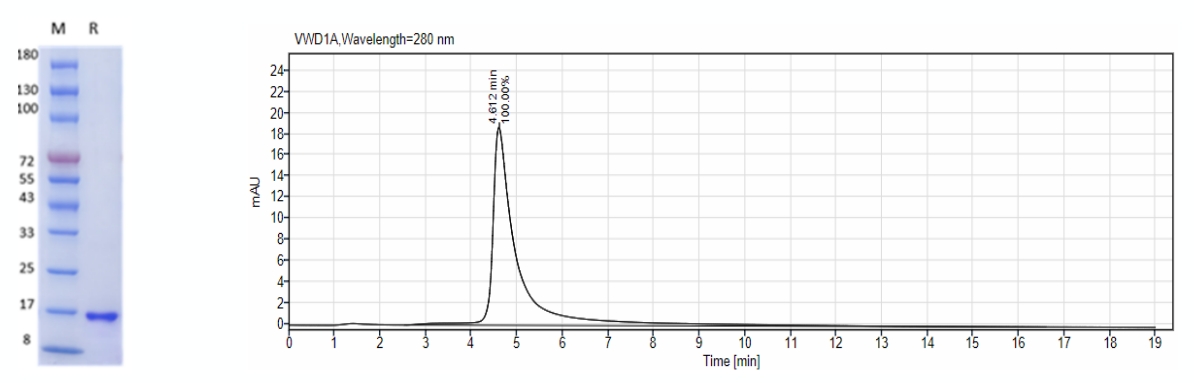
图 1. SDS-PAGE和HPLC鉴定GMP级 Human bFGF蛋白纯度:纯度>95%,未见杂蛋白
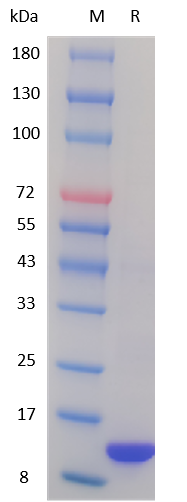
图 2. SDS-PAGE鉴定GMP级Human IL-3蛋白纯度:纯度>95%,未见杂蛋白。
2.高生物活性
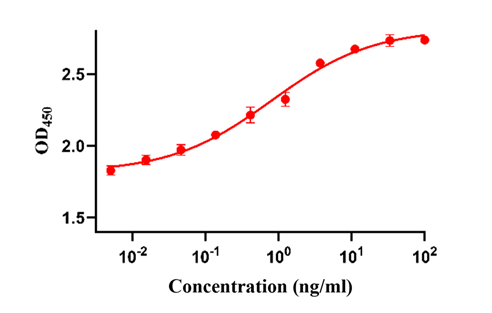
图3. 刺激balb/c 3T3细胞增殖实验结果显示,GMP级Human bFGF的细胞活性高于5.0×10^6 IU/mg

图4.刺激TF-1 cells细胞增殖实验结果显示,GMP 级Human IL-3 的细胞活性高于1.7ⅹ10^6 IU/mg
3.高稳定性
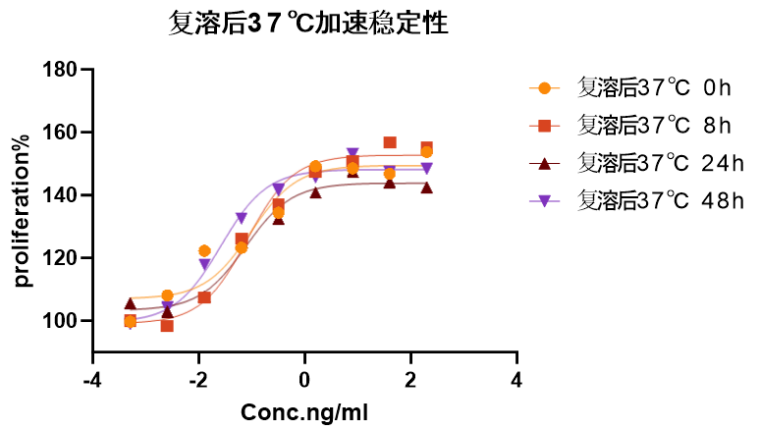
图5.刺激Human TF-1 cells细胞增殖实验结果显示,GMP级Human IL-3 蛋白复溶后37℃在 48小时是稳定的
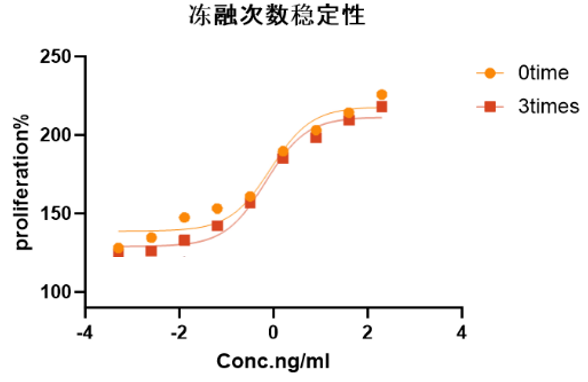
图6.细胞活性实验结果显示,GMP级 Human IL-3 蛋白反复冻融3次是稳定的
4.高批间一致性
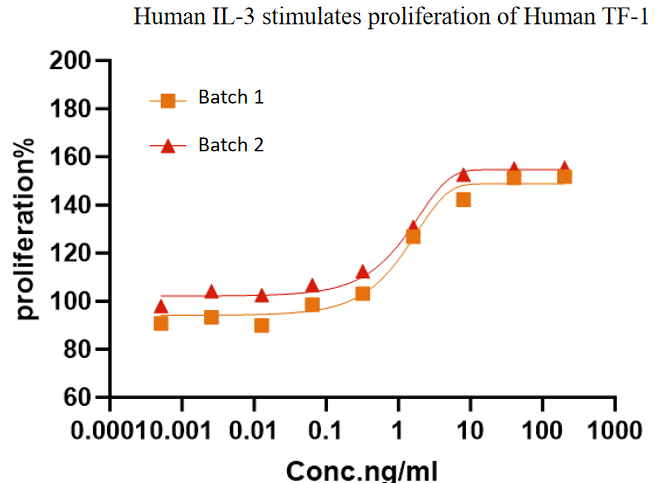
图7.GMP Human IL-3 不同批次的细胞活性保持一致,具有高批间一致性
试用装申请
翌圣生物隆重推出GMP级重组人IL-3和bFGF线上申请0元试用活动。每个客户每个产品申请限量为1支10ug。需在收到试用装1个月内反馈试用结果(试用结果信息YEASEN仅做内部参考)。 扫描下方二维码申请吧!

相关产品信息
|
产品名称 |
产品货号 |
产品规格 |
|
Recombinant Human FGF basic/FGF2/bFGF GMP Protein 重组人碱性成纤维细胞生长因子(GMP级) |
10μg/50μg/100μg/1mg |
|
|
Recombinant Human IL-3 GMP Protein 重组人白介素-3(GMP级) |
10μg/50μg/100μg/1mg |
