干货|见微知著,PCR那些不为人知的小细节!
在分子生物学的实验室里,聚合酶链反应(PCR)是日常工作中不可或缺的一部分。这项技术以其高效、快速和特异性强的特点,成为了基因克隆、诊断检测和研究中的核心工具。然而,即便是经验丰富的实验者,也可能在PCR实验中遇到一些难以察觉的陷阱。小翌将带你深入探索那些在PCR实验中容易被忽视,却又至关重要的小细节。
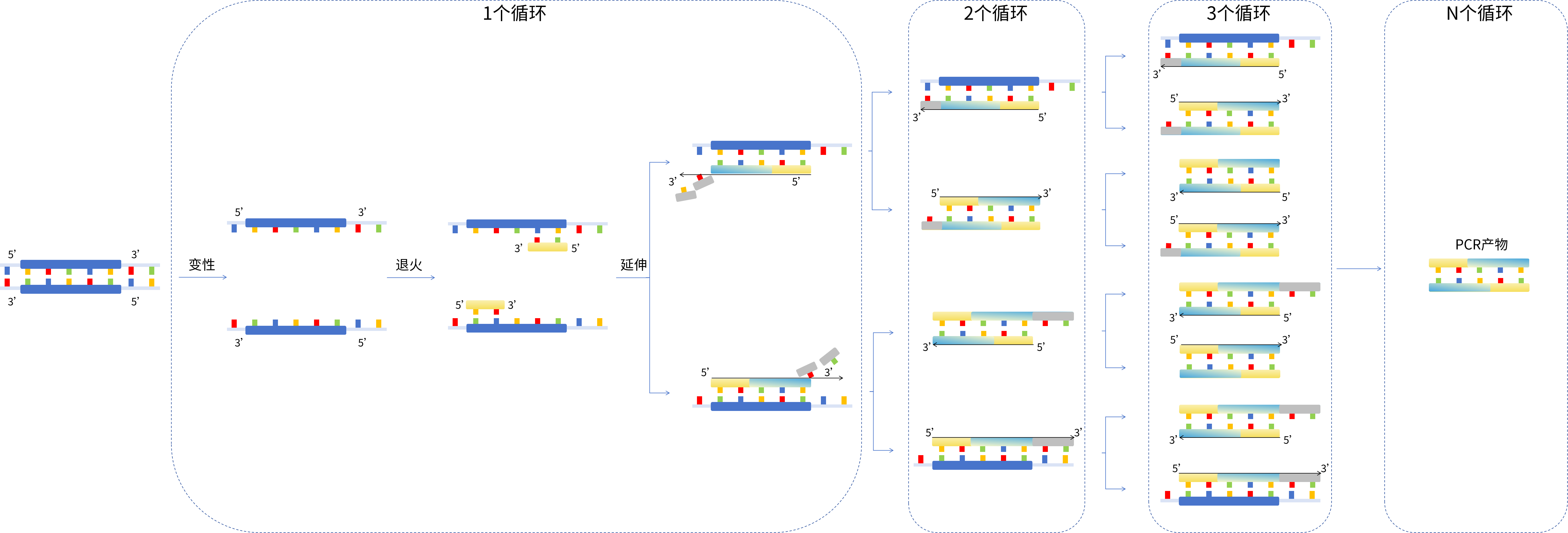
PCR原理图(点击查看大图)
PCR原理解析
PCR(聚合酶链式反应)的原理是DNA要经历变性、退火、延伸步骤才能与引物、DNA聚合酶、dNTP结合形成新的双链DNA分子,但实际需要的目标片段,得在三个循环之后才能得到。因此扩增循环数不能低于3,推荐循环数为30-40个循环。PCR产物的得率计算公式为:
PCR产物得率=2N copies(N代表循环数)
但实际上,随着循环数的增加,体系中的Taq酶、dNTP、引物等逐渐被消耗并伴随着副产物的生成,使得PCR不能呈指数扩增,从而使实际的扩增曲线呈现“S”型,通常分为基线期、指数增长期和平台期三个阶段,如图所示。
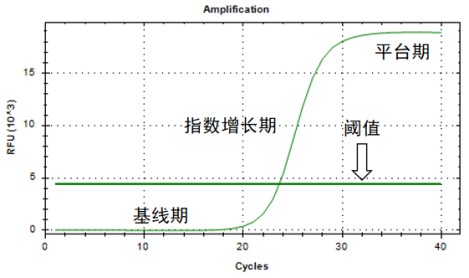
PCR扩增曲线
循环数作为一个关键步骤,直接影响PCR反应的结果。
陷阱一:循环数不足
如果DNA模板量较少,而循环次数太少,会导致目标DNA片段扩增产量低。
陷阱二:循环数过多
过多的循环虽然能增加产物量,但会导致反应时间过长,非特异性产物扩增和假阳性的风险也随之上升。一般而言,PCR产物在25~35次循环后即可达最大值,进入“平台期”。随着副产物的积累以及试剂的消耗,即使再增加循环数,PCR产物量也不会再有明显增加,出现扩增无法持续的停滞现象。
 翌圣新推出的新一代快速PCR试剂(Cat#10167ES)可以抑制【扩增无法持续的停滞现象】,仅需30-35个循环数,即可获得高得率的PCR产物。
翌圣新推出的新一代快速PCR试剂(Cat#10167ES)可以抑制【扩增无法持续的停滞现象】,仅需30-35个循环数,即可获得高得率的PCR产物。
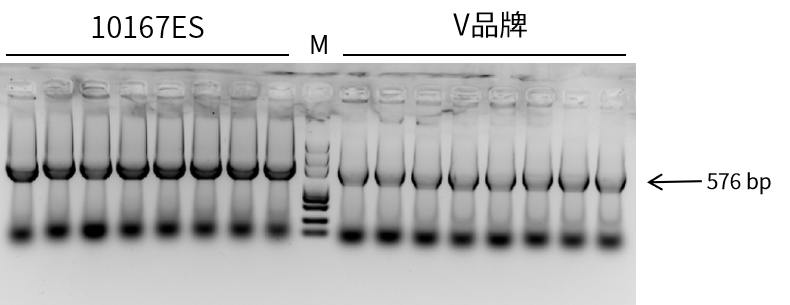
图1. 10167扩增576 bp大肠杆菌菌液,基因来源:拟南芥,性能优于竞品。延伸时间为30 sec/kb。循环数34 cycles。
引物
陷阱一:引物设计
引物设计过程中,需考虑TM值,GC含量、引物长度、引物二聚体的形成,但是往往会忽视3’末端的碱基,小翌建议小伙伴们引物3’末端的碱基最好为G或者C,可以提高引物与模板之间的结合稳定性,降低产物的错配。
陷阱二:引物浓度过高/过低
正常引物合成的量为2 OD,引物最初为干粉状,依据引物质量添加水至100 μmoL/L浓度(储存液),要使用时稀释10倍至10 μmoL/L浓度(工作液)即可。
在干粉状阶段,务必在3000 rpm/min条件下,离心1 min。如果未离心,在引物寄送的过程中,随着快递的上下翻飞,干粉会挂壁在管内各处,添加的去离子水无法与所有引物混合,导致引物浓度变低,在后续的实验中可能会导致目的片段的少量扩增或无扩增。
那有的小伙伴希望PCR产物量高,多加一点引物可以吗?也是不行的,引物浓度如果过高,易造成错配和非特异性扩增,且引物自身结合的概率增大,更易生成引物二聚体。
如下表显示,10167ES引物添加量的终浓度为0.4-0.5 μM。依据说明书进行实验,PCR实验就可以事半功倍哦~
|
组分 |
体积(μL) |
体积(μL) |
终浓度 |
|
2×Hieff® Ultra-Rapid II HotStart PCR Master Mix* |
25 |
12.5 |
1× |
|
模板** |
x |
x |
- |
|
正向引物F(10 μM)*** |
2 |
1 |
0.4-0.5 μM |
|
反向引物R(10 μM) |
2 |
1 |
0.4-0.5 μM |
|
ddH2O |
Up to 50 |
Up to 25 |
- |
陷阱三:引物污染
因为小伙伴的引物作为反复冻融使用的材料,在使用过程中易造成污染,导致非特异扩增,所以小翌建议在使用过程中,引物作为ddH20之后,优先添加的材料,防止因枪头未更换等因素污染引物。
加样步骤推荐:ddH20>引物>模板>Mix酶
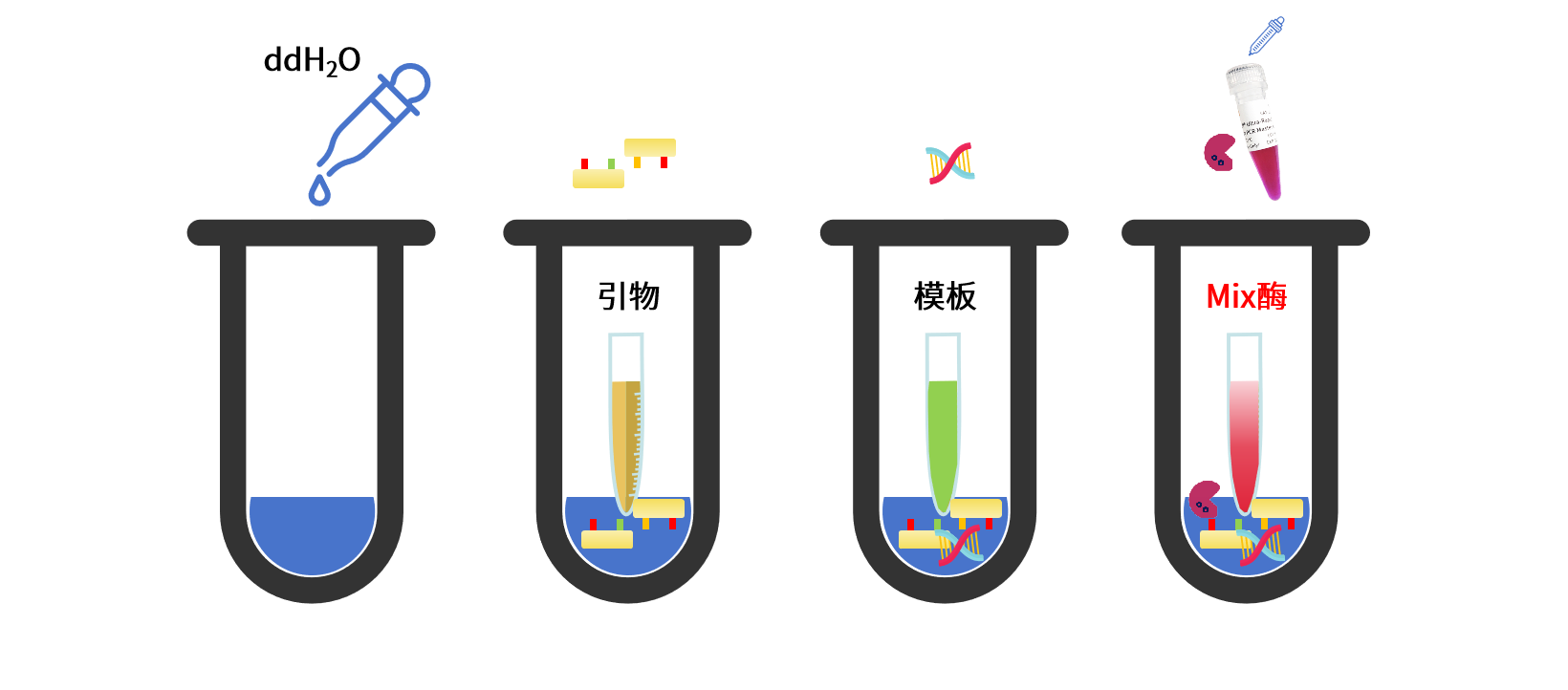
Mix酶最后添加:防止因过早添加酶试剂导致引物提早合成引物二聚体,避免非特异扩增,且大部分PCR Mix酶携带指示剂,可以用于区分该试管是否加样完成。
需注意,PCR为冰上操作的实验,但冰块融化之后,如冰水浸没引物、模板管子,易造成交叉污染,导致阴性对照出现假阳性。建议丢弃被冰水浸没过的试剂,更换新试剂做实验。或使用金属冰盒,可避免发生浸没的情况。
模板
陷阱一:模板DNA浓度
模板DNA在储存的过程中会有一定程度的降解,因此放置前测试的浓度不一定准确,为了保证实验精度,在放置一段时间后,需重新测试DNA模板浓度。
陷阱二:模板处理
小翌提醒,在进行酵母菌P的时候,需尽量将酵母模板处理好,有助于提高PCR扩增效率:酵母菌菌液及菌株煮沸5 min后放入-80℃冰箱3 min,待解冻后上样。
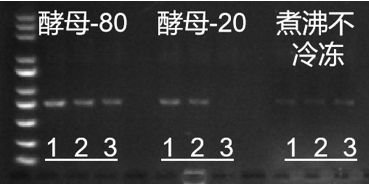
10167ES扩增酵母菌
PCR技术虽然基础,但也需要精确的控制和细心的调整。通过关注这些小细节,可以提高PCR实验的成功率,为你的实验和研究打下坚实的基础。小翌提醒大家,见微知著,每一个小细节都可能成为PCR成功的关键。在分子生物学的世界里,细节往往决定成败。小翌希望能够帮助各位科研工作者更好地理解和掌握PCR技术,从而在研究中取得更好的成果!
产品推荐
2×Hieff® Ultra-Rapid II HotStart PCR Master Mix快速PCR预混液升级版
快速、高效、抑制停滞现象、提高产量
性能展示
菌落快速、高效扩增
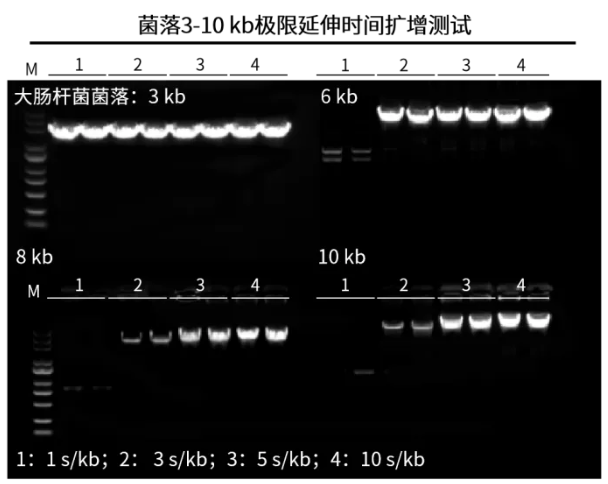
图1. 大肠杆菌菌落极限延伸时间扩增测试,3 kb以内片段10167ES扩增的延伸效率可达1 sec/kb,6 kb片段扩增的延伸效率可达3 sec/kb,6-10 kb片段扩增的延伸效率可达5 sec/kb。M:10,000 DNA Marker(10505ES)。
长片段+高GC菌液快速、高效扩增

图2. 长片段+高GC菌液扩增,结果显示10167ES扩增产量高,检出率100%,性能优于竞品。M:10,000 DNA Marker(10505ES)。10167ES扩增速度10 sec/kb,竞品扩增15 sec/kb。
|
产品定位 |
名称 |
货号 |
规格 |
|
快速PCR升级,可菌P且适用复杂模板扩增 |
2×Hieff® Ultra-Rapid II HotStart PCR Master Mix |
1 mL/5×1 mL |
|
|
1-7片段一步法定向连接,最快5分钟完成重组反应 |
Hieff Clone® Universal II One Step Cloning Kit |
20 T/50 T |
