复制型逆转录病毒(RCR)的法规监管要求和检测方法介绍
逆转录病毒简介
病毒是一种由核酸分子和蛋白质构成的非细胞形态生物,能够携带基因进入受体细胞,经开发和改造后可用作细胞基因治疗(CGT)载体。通过改造后的病毒载体一般具有更好的安全性和更快的分子克隆速度,同时感染能力也得到了定向进化,从而具备了更快捷、更广谱的转导特性,以及更安全、更特异的感染特性。然而由于病毒的多样性及宿主机体的高度复杂性,目前仅腺病毒、腺相关病毒、慢病毒、逆转录病毒和溶瘤病毒等少数种类可改造为CGT载体。
其中,逆转录病毒(Retrovirus)又称反转录病毒,是一种RNA病毒,病毒颗粒为二十面体对称结构、球形,有包膜,表面有刺突。逆转录病毒需在逆转录酶的作用下,将RNA转变为cDNA,新合成的cDNA插入宿主的核DNA中,随宿主DNA复制、转录、翻译达到扩增目的。
按照目前国际病毒分类标准,逆转录病毒科分为7个属:α逆转录病毒属、β逆转录病毒属、γ反转录病毒属、δ反转录病毒属、ε反转录病毒属、慢病毒属和泡沫病毒属。在这些逆转录病毒中,仅γ-逆转录病毒和慢病毒用于临床。
因此,通常所说的逆转录病毒载体是指在γ逆转录病毒(GRV)的基础上改造获得的,主要包括MMLV(莫洛尼氏鼠白血病逆转录病毒)和MSCV(鼠干细胞病毒)。这些载体能够将外源基因有效地整合到宿主细胞的基因组中,实现长期稳定的基因表达。
γ-逆转录病毒载体具有简单的基因组结构,由以下蛋白质编码基因组成:gag、pol和env。Gag编码衣壳蛋白,Pol编码病毒酶(逆转录酶、整合酶和蛋白酶),Env编码囊膜蛋白。

图1. 基于小鼠白血病病毒(MLV)的γ逆转录病毒基因组的结构(doi:10.3390/v3060677)
γ-逆转录病毒载体包装系统通常包括三个关键的质粒:包装质粒(含有γ-逆转录病毒的gag、pol和rev基因)、载体质粒(包含目的基因、选择标记基因以及必要的病毒序列)和包膜质粒(含病毒粒子的表面蛋白,如env基因)。
γ-逆转录病毒载体的生产平台主要有两种:一种是瞬时工艺,采用上述三质粒系统,共转染到HEK293T包装细胞系中,进行病毒制备;另外一种是稳定工艺,即以表达包装和囊膜基因的包装细胞系制备稳定产毒细胞株(如PG13)。
复制型逆转录病毒(RCR)概念及法规监管要求
通常,通过改造将逆转录病毒中与病毒包装和转导相关的基因删除,替换为需要表达的外源基因,因此生产的病毒颗粒是复制缺陷型的,无法在细胞内复制并组装为新的病毒颗粒,但能将外源基因整合到宿主基因组中持续表达。
目前制备CAR-T细胞所用的慢病毒和γ-逆转录病毒载体均为复制缺陷型,已极大降低了产生复制型病毒的风险,但病毒载体的制备方法以及制备过程中仍存在产生复制型慢病毒或复制型逆转录病毒的潜在风险。这些风险主要源自:病毒载体生产过程中,因穿梭质粒、包装质粒及包装细胞(eg.HEK293/HEK293T)中的内源性逆转录元件之间发生的同源或非同源重组;慢病毒载体与T细胞的内源性逆转录元件之间发生的同源或非同源重组。
因此,复制型病毒(RCV)可能在病毒载体生产阶段、CAR-T细胞制备阶段,甚至在患者接受治疗后,随着CAR-T细胞在体内的持续扩增,依然存在产生RCL/RCR的潜在风险。终产品中复制型病毒的存在有可能引起病人不良反应,构成临床隐患和潜在危险,故对复制型病毒检测是安全性检测中非常重要的项目。
随着病毒载体在CGT领域应用越来越广泛,相关法规和技术原则对监测复制型病毒提出了建议。
国家药品监督管理局药品审评中心(CDE)在2020年9月发布《基因转导与修饰系统药学研究与评价技术指导原则(征求意见稿)》:采用复制缺陷型或条件复制型病毒载体时,应在生产工艺的适当阶段检测生产过程中可能产生的具有复制能力的病毒、亲本病毒或野生型病毒进行检测,并根据给药剂量等确定残留量的标准限度。常见的复制型病毒检测方法包括指示细胞培养法、直接qPCR法等。可复制型逆转录病毒(RCR)检测:建议采用敏感的指示细胞培养法进行RCR检测。RCR扩增细胞与待测样本进行共培养以最大程度扩增RCR,在一定传代次数和时间的传代培养后取适量上清接种RCR指示细胞培养,以观察、计数细胞病变集落或者进行RCR标志物的检测。
2022年5月,CDE发布的《体外基因修饰系统药学研究与评价技术指导原则(试行)》中提到RCR:


美国FDA 2020年发布的关于RCR/RCL检测指南提出:对于RCR/RCL的检测包含指示细胞培养法、ELISA法(p24蛋白测定)、PCR/Q-PCR法(通过psi-gag或VSV-G聚合酶链反应)、PERT法(产物增强性逆转录检测法)共4种检测方法。
复制型逆转录病毒(RCR)的检测
中美欧三国监管机构对于复制型病毒的控制阶段和检测要求基本相同,在产品生产的各个阶段以及在接受基于病毒载体的基因治疗的患者后续监测中进行检测。并且各监管机构推荐的复制型病毒的检测方法均是指示细胞培养法,该方法是复制型病毒检测的金标准。
但考虑到CAR-T细胞终产品一般需要新鲜输注的特殊情况,基于细胞培养法的RCL/RCR检测方法周期较长,建议在细胞产品制备过程中进行全面控制(如对慢病毒载体及生产终末细胞采用基于细胞培养方法测定RCL/RCR,以确保生产工艺过程中不存在RCL/RCR的风险),细胞终产品阶段可采用qPCR快检法快速放行。
针对上述情况,翌圣生物自主研发了复制型逆转录病毒RCR检测试剂盒,采用荧光探针RT-PCR法特异性扩增逆转录病毒载体上包含env在内的序列,专一快速的检测各种使用逆转录病毒载体相关的细胞产品中可能发生的复制型逆转录病毒的潜在风险。还研发了与之配套使用的宿主细胞残留DNA样本前处理试剂盒,以及配套的自动化核酸提取仪器。
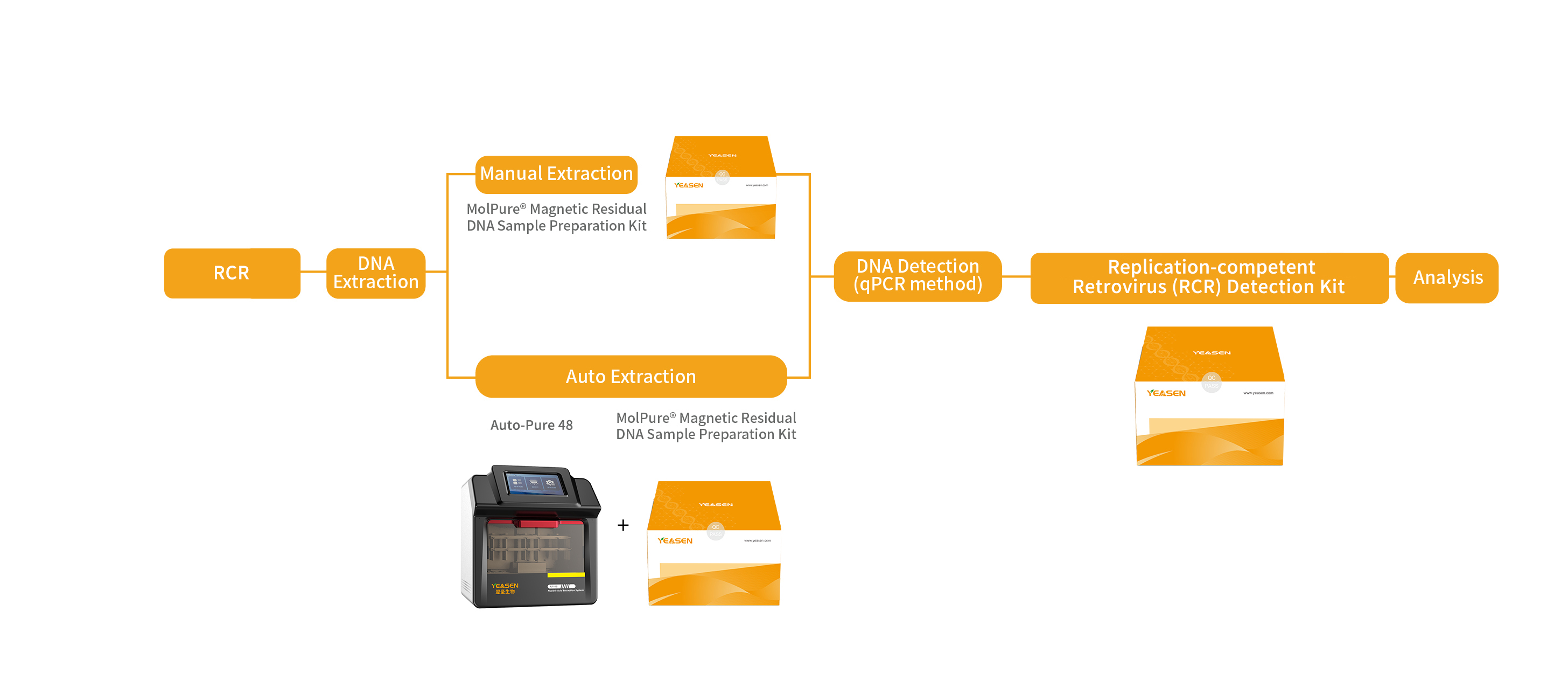
产品资质
-
符合法规:按照EP2.6.7、JP G3和USP 63药典要求验证,符合国际权威机构的标准;
-
配合审计:产品生产符合ISO13485质量体系标准,有完善的审计文件;
-
保障品质:试剂盒所需酶原料全自产,且已产业化,供货稳定;
-
技术经验积累:TaqMan法有技术沉淀,使得Kit灵敏度高;
-
专注产品性能:Taq酶抗体库,双封闭抗体提高了Kit特异性、稳定性等。
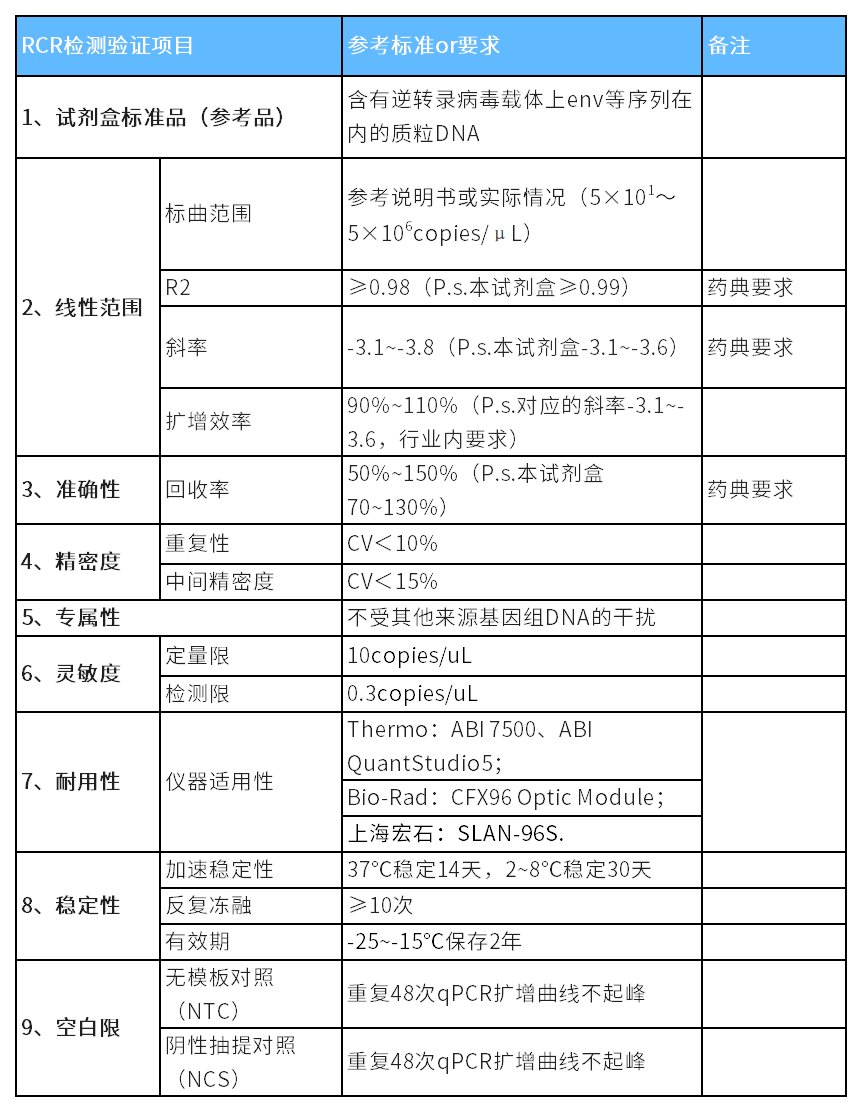
验证内容
产品信息
|
产品 |
货号 |
品名 |
规格 |
|
样本前处理 试剂盒 |
18461ES |
25T/100T |
|
|
18467ES |
3×16T/ 6×16T |
||
|
核酸提取仪器 |
80511ES |
48通量 |
|
|
RCR检测试剂盒 |
41329ES |
50T/100T |
