如何定量低丰度目的基因的表达(含详细解决方法)
有时候,qPCR实验会成为阻碍你课题顺利开展的强势拦路虎!看似简单的基因表达量差异验证,当遇到低丰富表达的基因时,也许就举步维艰。模板获取困难导致的RNA提取量少或RNA质量不佳,即使选用最佳的试剂、筛选出最良好的引物,也有可能qPCR定量得到的内参基因CT值在18-20个cycle,而目的基因在31-35个循环。遇到这种情况,你是怎么解决的呢?
qPCR在低丰度表达基因定量中的局限性
基因的丰度是指基因在基因组中的绝对拷贝数。可分为高丰度,中等丰度和低丰度。低丰度是指目的基因在基因组中的拷贝数低,可简单认为2ng 总RNA中低于100个拷贝数的基因。从qPCR实验结果来讲,当扩增效率为100%,模板加入量在1-10ng范围内,qPCR得到的CT值高于28时即可认为低丰度基因,如下表所示。

对低丰度表达和超低丰度表达的基因进行qPCR实验,会出现两个难点:一是如何保证定量结果的准确性;二是如何对得到的结果进行数据分析。
如何定量好低丰度目的基因?
定量结果的准确性需要依赖定量实验的合理设计。低丰度基因定量实验常常出现以下情况:样品复孔间重复性差(见下图)、PCR扩增效率低不能有效反映或接近基因的实际表达量。
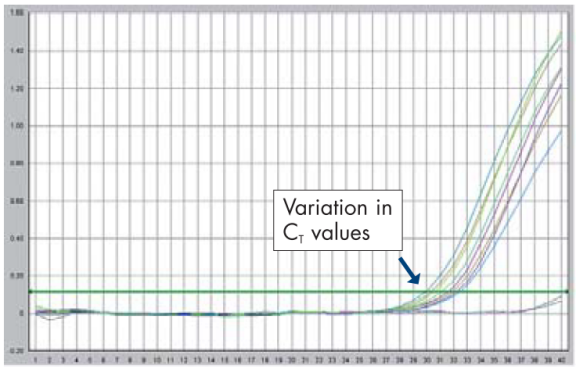
一、如何保证定量结果的准确性
a. 保证复孔间的重复性
低拷贝基因在总RNA中的分布极不均匀,容易引起复孔间的误差,造成重复性差。
建议:
1、在保证仪器等设备校准的情况下,可以增加cDNA的稀释倍数,增加上样体积,减少移液误差;
2、增加复孔数,对偏差较大的数值予以舍弃;
3、还有一种方法就是引入一种不相关的carrier DNA(or RNA), 这些物质不跟目标基因发生反应,不干扰基因的检测,减少移液过程中靶基因粘壁或枪头的损耗。
b. 保证引物的扩增效率
qPCR扩增效率的要求是在90-110%。理论上,每对引物均需要预实验进行标准曲线确认扩增效率,说到底qPCR反应包含模板,引物和反应试剂,因此可从以下角度优化扩增效率:
1、模板质量的要求:模板纯度低,含抑制剂会抑制PCR扩增,不利于qPCR实验的进行。模板发生降解,引物无法有效退火到目标区域,也会造成扩增效率下降。高质量的模板从来都是进行qPCR实验的要求之一!
2、优化引物设计:常见的引物设计原则可自行百度。非特异性扩增会竞争消耗引物和Taq酶,也会降低目标基因的扩增效率。引物二聚体可参照下一条介绍。
3、引物浓度优化:引物浓度高,模板浓度过低,会引起引物二聚体的形成。对于低丰度基因而言,引物二聚体与SYBR Green I结合产生的荧光,会干扰背景值,造成试剂检测灵敏度下降!
4、试剂的选择:选用特异性好,检测灵敏度高的qPCR预混液。当然,相对于二步法qPCR定量而言,选取一步法RT-qPCR无疑会有更好的灵敏度,该方法将反转录和qPCR置于一管,增加了检测的灵敏度。
二、如何对定量结果进行分析
下面我们从扩增效率角度和内参基因与目的基因△CT值的差异进行解释低丰度基因定量数据的评判标准。
a.当内参基因和目的基因的扩增效率一致,且扩增效率均接近100%:
1、内参基因和目的基因的△CT值相差较大时,如内参基因Ct值在20,目的基因Ct值在32。
当遇到以上情况,且实验的样本材料较珍稀或RNA纯化量较少,可考虑以下分析方法。
首先构建质粒标准品,做标准曲线,测定TNF(目的基因)和HPRT(内参基因)扩增效率,如下表。

由上表可以看出,内参基因与目的基因的△Ct值相差均匀,表明扩增效率接近。
当研究“Jurkat cells were untreated or treated with PMA”,TNF表达量计算如下表:

可以看出,以上数据直接按照正常的△△Ct法分析即可。该分析方法的前提是qPCR试剂可准确定量超低浓度模板量。
2、内参基因和目的基因的△CT值相差较小(适用于样本RNA量多时)
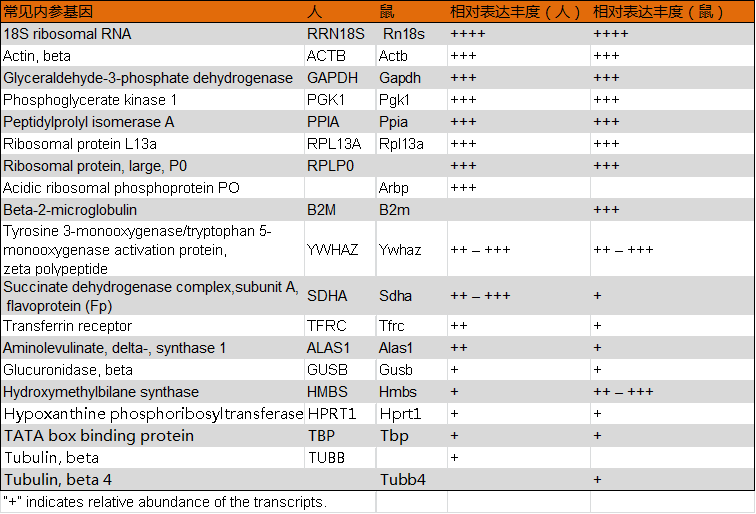
当选用的qPCR试剂检测范围较小时,对低浓度模板不能准确定量,可增加模板加入量,使内参基因和目的基因均在试剂检测的有效范围。此时的关键在于选择表达丰度和目的基因相近的内参基因。内参基因的选择依据有二:一是不受作用因素的影响且表达量相对恒定;二是选取多个内参基因,均一化误差。下表列举了常见的内参基因,丰度从高到低,根据目的基因表达丰度选取1-3个进行对照校正。
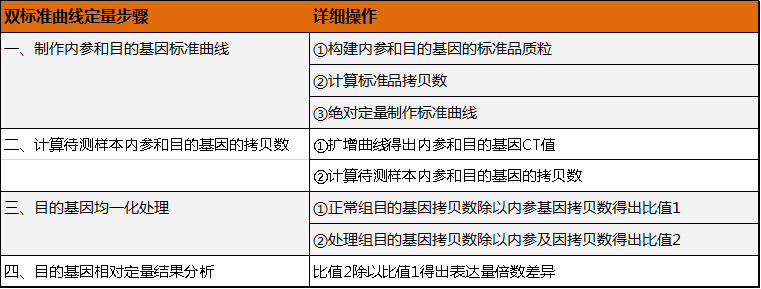
b.内参基因和目的基因的扩增效率不一致,但均在90%-110%之间——双标准曲线法
利用双标准曲线法计算基因的相对表达量。
附高通用型定量试剂 https://www.yeasen.com/news/detail/111
HB180724
