上新|高效、合规支原体qPCR试剂盒(2G),快速普适检测新选择!
近些年,随着生物医药迅猛发展、疫情下细胞基因治疗以及mRNA疫苗的相继涌现,如何把控生物制品安全可靠,成为各国法规政府重视以及监管的要点。支原体是一种比较常见但通常难以去除的污染类型,对于涉及细胞培养的生物制品工艺过程,法规要求“必须确保无支原体污染”。
监管机构要求的支原体检测点
2020版中国药典三部《生物制品生产检定用动物细胞基质制备及质量控制》中提出对于生产用细胞,需要对主细胞库(MCB)、工作细胞库(WCB)、生产终末细胞(EOPC)进行支原体检查;
《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》中建议在关键时间点对适合的中间样品开展支原体等安全性相关检测或采取相关的措施加以控制,并且支原体同样需要作为终产品的放行检项;
FDA , Guidance for Industry : Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications,中提出对于原材料、病毒种子、未加工的收获液等都需要进行支原体控制。
NAT法和传统方法
在快速检测方法(NAT,核酸扩增技术)出现之前,传统的培养法和指示细胞法因其检测周期长或灵敏度问题,致使企业生产或产品放行周期拉长或者需要基于风险评估对细胞原料进行条件放行或者寻求其他替代方法。而随着细胞基因治疗的发展,行业内对支原体检测时效性和灵敏度要求越来越高,短的货架期不足以支撑如此长的检测周期,因此NAT方法从众多支原体检测方法中脱颖而出。
目前欧洲药典(EP)<2.6.7>,日本药典(JP)以及美国药典(USP)<63>都已收录NAT方法作为支原体检测方法,但需要对该方法进行验证以及与传统方法进行对比其检测灵敏度不低于传统方法,才可以使用。2020版中国药典(ChP)虽然并未收录NAT法作为支原体检测方法,但其中也提到了“也可采用经国家药品检定机构认可的其他方法”。2022年5月,国家药监局药审中心发布的《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》中提到“当检验样品量有限,或需要快速放行等特殊情况下,如药典方法无法满足,可考虑开发新型的无菌和支原体的检测方法进行放行检测,但是新型检测方法应经过充分验证”。所以NAT法有望作为能够支持快速支原体放行检测的方法,被越来越多的原材料供应商、以及ATMP企业所使用。
中外法规里列举的支原体检测方法

翌圣生物MycAway®支原体qPCR检测试剂盒(探针法)(2G)是基于NAT (nucleic acid amplification techniques)的一种快速定性检测生产原料、细胞库、病毒种子、病毒或细胞收获液、治疗用细胞中潜在支原体污染的产品。
该试剂盒基于定量PCR技术,采用多重PCR的方法,使用2种荧光探针,FAM和CY5,分别检测目标序列和内参。相较40618ES货号的支原体qPCR检测试剂盒,该2G版本可覆盖多达183种支原体DNA序列,所需待测样本的模板量也减少了一半,还可兼容更多品牌的qPCR仪器。
同时,MycAway®支原体qPCR检测试剂盒(探针法)(2G)也严格按照EP 2.6.7进行专属性、检测限、耐用性的全面验证,检测限满足≤10 CFU/mL的要求。同时覆盖USP、JP、WHO、ChP等中要求验证的支原体菌株类型,试剂盒性能符合中外法规要求,助力生物医药客户的药物研发项目临床实验申请等的顺利受理。
产品资质
符合法规:按照EP2.6.7、JP G3和USP 63药典要求验证,符合国际权威机构的标准;
配合审计:产品生产符合ISO13485质量体系标准,有完善的审计文件;
保障品质:试剂盒所需酶原料全自产,且已产业化,供货稳定;
技术经验积累:TaqMan法有技术沉淀,Kit灵敏度可达10CFU/mL及以下;
专注产品性能:Taq酶抗体库,双封闭抗体提高了Kit特异性、灵敏度、稳定性。
产品特点
检测种类多:优化的TaqMan探针可检测多达183种支原体;
操作简便:样本制备和检测总时长<3h,无需培养法的28天等待;
灵敏度高:检测限达到可以替代直接培养法的10CFU/mL;
专属性强:针对16s rRNA设计引物探针,不与梭菌、乳杆菌等亲缘关系物种交叉反应;
安全性高:试剂盒内阳性对照(PC)无感染性,完全消除污染风险;
防干扰强:引入内部质控(IC),可排除样本干扰、反应配制异常等因素,有效避免假阴性。
完整解决方案
翌圣生物NAT法支原体qPCR检测
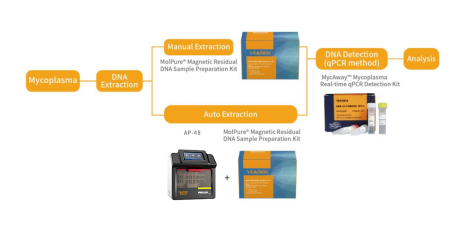
翌圣生物MycAway™支原体qPCR检测试剂盒(探针法)能够与MolPure®磁珠法残留DNA样本前处理试剂盒搭配使用,可以通过手动提取或者使用自动化核酸提取仪自动提取样本核酸。样本经过前处理去除干扰杂质获得纯化的支原体DNA后,通过qPCR收集探针的荧光信号,从而对检测结果进行判定。
验证内容
|
性能 |
验证参数 |
试剂盒验证结果 |
|
检测限 |
支原体菌株检测限 |
10种法规药典要求的支原体10CFU/mL,分别检测24次,检出率≥95% |
|
专属性 |
样本基质干扰 |
检测了9种样本基质和DNA稀释液,均未检出支原体 |
|
交叉反应 |
检测了14种菌株、6种生物医药常用工程细胞,均未检出支原体 |
|
|
耐用性 |
冻融稳定性 |
可经受反复20次冻融,试剂盒性能不受影响 |
|
热加速稳定性 |
37℃条件下14天和4℃条件下30天,试剂盒性能不受影响 |
|
|
仪器适用性 |
适用ABI7500、ABI QuantStudio™5、Bio-Rad CFX96、罗氏LightCycler®480 |
|
|
覆盖度 |
覆盖支原体DNA种类 |
通过支原体16SrRNA序列进行数据库比对,覆盖183种柔膜菌纲物种 |
产品信息
|
产品 |
货号 |
品名 |
规格 |
|
样本前处理 试剂盒 |
18461ES |
MolPure® Magnetic Residual DNA Sample Preparation Kit磁珠法残留DNA样本前处理试剂盒(瓶装) |
25T/100T |
|
18467ES |
MolPure® Mag48 Sample Preparation Kit FN 磁珠法48孔样本前处理试剂盒FN(预封装) |
3×16T/ 6×16T |
|
|
核酸提取仪器 |
80511ES |
48通道自动化核酸提取仪 |
48通量 |
|
支原体检测 试剂盒 |
40619ES |
MycAway® Mycoplasma Real-time qPCR Detection Kit (2G) 支原体qPCR检测试剂盒(探针法)(2G)
|
25T/100T |
