一文掌握HCP全套检测方法:商品化or定制化&抗体覆盖率
HCP概念和检测的必要性
生物制品通常是通过重组技术经由宿主细胞(如细菌、酵母、哺乳动物、昆虫或植物细胞)进行生产的,产品类型包括单克隆抗体、重组蛋白和疫苗等。这些产品的制造和纯化过程不可避免的会引入宿主细胞蛋白(Host Cell Protein,HCP)杂质,既包括宿主细胞的结构蛋白也包括宿主细胞分泌的促生长因子等,是具有多种生理化学和免疫学特性的复杂混合物。尽管使用先进的纯化技术,但一些宿主细胞蛋白仍将作为工艺相关杂质残留在中间药物产品中。
这些杂质有潜在的免疫原性,也可能作为佐剂增强生物药物的产品的免疫反应,还会影响产品的稳定性和功效,从而引发人体安全性风险,因此,对于HCP的去除水平需要建立合适的监测策略,并控制终产品中HCP的含量以符合药物质量的要求。
HCP法规监管要求
生物制品中HCP残留含量通常被认为是产品的关键质量属性(CQA),是工艺稳健性监测的重要评价指标,也是产品的重要质控指标。各国法规都有涉及HCP的论述,要求必须对生物药品进行分析和纯化,以将宿主细胞蛋白HCP降低到可接受的水平。对HCP的接受程度将根据具体情况进行评估,并取决于多个因素,其中包括:剂量、给药频率、药物类型和疾病严重程度。
-
《中国药典》三部(2020版)规定:针对CHO细胞,HCP残留需要<0.05%(相当于小于500ppm);针对E.coli,HCP残留需要<0.01%。
-
美国药典USP<1132>章节规定:用一种灵敏度较高的方法检测药品中的HCP,其含量应该低于检测限(通常小于100ppm,即1mg总蛋白中HCP含量应小于100ng,也即<0.01%)。
-
欧洲药典EP 2.6.34中规定:在生物制品中,HCP的含量应当小于0.1%。
-
国际人用药品注册技术协调会(ICH)指南:ICH Q6B指出,需要根据ICH准则采用敏感且经过验证的有效方法来监控残留的HCP,其残留量通常要求小于100ppm。
由此可见,监管机构对于HCP的要求是高度一致的,生物制品的工艺开发必须经过HCP检测,并证明纯化工艺能够将HCP降低到安全水平,并且在最终产品的残留量限值中,中美的推荐限度值均在0.01%以下。
HCP检测方法
酶联免疫吸附法(ELISA)是目前HCP检测最常用的方法,在2020版《中国药典》通则3412/3413/3414中提到的宿主蛋白残留检测方法均为ELISA法。
美国药典USP<1132>章节中也提到可采用电泳法、ELISA和LC-MS/MS等方法检测HCP含量,且由于ELISA法操作简便、快速、高灵敏、高通量等特点,而被推荐为HCP检测的首选方法。
酶联免疫吸附测定(ELISA)
用途:
检测HCP中蛋白的总量,可用于产品开发和过程控制,目前是检测HCPs的常用方法。
优势:
-
高灵敏度和特异性;
-
高通量及可实现自动化;
-
定量性;
-
操作简便、快速。
劣势:
-
需要特异性抗体;
-
无法特异鉴别和评估单个HCP;
-
方法开发较为复杂,抗原需要特殊制备;
-
方法的影响因素较多,HCPs覆盖率需评估;
-
无法鉴定出种类。
免疫印迹(Western Blotting)
用途:
用于大量样品的一致性筛选,以及检测与抗HCPs抗体反应的未知蛋白。适用于检测HCPs,并提供HCPs相对分子质量的大概信息。
优势:
-
特异性;
-
结果直观可视化:通过蛋白质大小和表达水平的差异进行可视化;
-
可检定和定量特定的HCP。
劣势:
-
半定量性;
-
仅限于特定蛋白:只能检测到与抗体结合的HCP;
-
对复杂蛋白质混合物不够敏感;
-
蛋白质SDS变性可能导致构象表位的丢失;
-
灵敏度需依赖多克隆抗体质量。
二维凝胶电泳法(2-DE)
用途:
常用于上游或下游工艺开发和表征,其可在单一凝胶上分辨不同HCPs。
优势:
-
不需要免疫印迹,避免了转膜的问题;
-
可以实现痕量HCPs杂质与产品的分离;
-
提供大概相对分子质量和等电点信息。
劣势:
-
过量的蛋白可能会掩盖HCPs斑点;
-
可观察到样品中HCP的分布,但无法量化。
质谱分析(Mass Spectrometry)
用途:
鉴定单个HCP,提供准确的宿主细胞蛋白鉴定和定量信息
优势:
-
高分辨率和准确性;
-
鉴定及监控各个HCP;
-
提供HCP的全面谱图;
-
能够覆盖广泛的蛋白质;
-
可鉴定出HCP种类。
劣势:
设备和技术要求高;
操作较为复杂;
成本较高;
方法通量低;
较为复杂的样品前处理;
潜在的基质影响;
需要专业的数据分析能力。
ELISA是各国药典推荐的在生物制品中检测残留HCP的方法,可以测定HCP的总量,但其存在局限性,无法鉴别HCP的种类及丰度,需要其他方法与之互相补充。每种检测方法都各有其优缺点,在实际应用中,可以根据实验目的、样品特性、准确性和操作便捷性等方面进行选择,结合使用不同的方法来获得更全面和准确的结果。
此外,美国药典USP<1132>和欧洲药典EP2.6.34. HOST-CELL PROTEIN ASSAYS指出在产品开发的不同阶段,推荐采用不同的ELISA试剂盒用于HCP的检测,并将HCP检测方法分为:商业化试剂盒、产品/工艺专属性方法和平台化方法。
USP<1132>提到在没有平台化方法的情况下可以在临床前、临床I期、II期使用商品化试剂盒;在临床III期/工艺验证及产品上市后,由于商业化的通用HCP检测试剂盒抗体的覆盖率往往不足等局限性,需要考虑结合细胞类型及工艺特异性等因素,使用平台化方法或针对上游工艺开发的产品/工艺专属性方法。
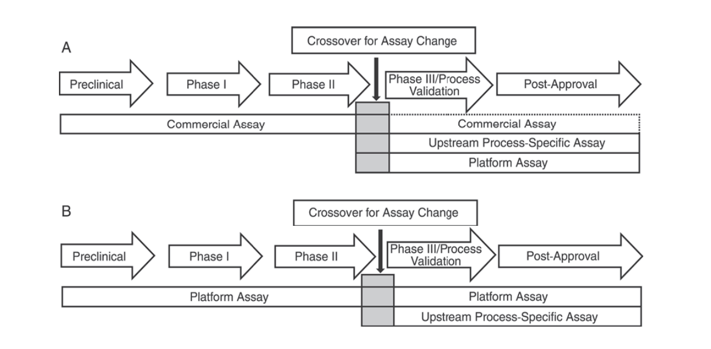
图1.USP <1132>中产品开发的不同阶段HCP检测方法的建议
|
方法 |
通用商品化试剂盒 |
项目专属性检测方法 |
平台化检测方法 |
|
可用性 |
即时可用 |
需要制备抗原,包括克隆空载体细胞系 |
需要使用裸细胞系或空载体细胞系制备抗原 |
|
开发 |
无需太多准备工作 |
包括抗原表征、免疫和确认在内的检测开发至少需要6个月时间 |
包括抗原表征、免疫和确认在内的检测开发至少需9个月时间 |
|
多样性 |
仅限于最常见的表达系统 |
各类型表达系统均可用 |
各类型表达系统均可用 |
|
特异性 |
特异性可能不佳,很可能有未检测到的HCP |
特异性通常有所增强,抗体覆盖率更能针对特定的HCP模式 |
与商业检测方法相比,特异性有所提高,对检测性能的理解有所增强,对HCP种类的覆盖率也有所提高 |
|
费用 |
初期价格相对便宜,但对整个下游纯化过程而言,开发成本将迅速上升 |
初期成本较高,但收支平衡点通常是在100套试剂盒的价值 |
由于可用于多种产品,具有显著的成本优势 |
|
依赖性 |
依赖于某个供应商,试剂和控制方案属于“黑箱”状态。 |
能对所有试剂和缓冲液取得全面控制,可以随时进行调整 |
对所有试剂具有完整的所有权和控制权,可降低供应链和批次可比性的风险 |
|
监管需求 |
不适合用于支持上市许可申请 |
适用于支持许可产品从早期开发到最终产品上市的整个过程 |
适用于支持早期开发直至上市许可的整个过程 |
表2.不同HCP试剂盒类型的比较
翌圣生物通用商品化HCP试剂盒
ELISA法是一种使用简单、灵敏度高且客观的HCP检测方法。翌圣生物科技(上海)股份有限公司自主研发了多款能够检测使用了宿主细胞进行转染以及蛋白表达的各生物制品下游纯化过程样品以及终产品中宿主蛋白残留量的试剂盒。试剂盒均采用双抗夹心酶联免疫检测(ELISA)的实验原理,以及生物素-链霉亲和素放大系统,能够高灵敏的检测样本中HCP残留量。试剂盒可以用于生物制品纯化工艺过程的优化、中间工艺过程的杂质控制以及终产品的放行检测。
|
宿主细胞残留蛋白检测 |
货号与网址 |
|
E.coli HCP ELISA检测试剂盒 |
36712ES https://www.yeasen.com/products/detail/5004 |
|
E.coli HCP ELISA 检测试剂盒(质粒) |
36721ES https://www.yeasen.com/products/detail/5984 |
|
HEK293 HCP ELISA检测试剂盒 |
36713ES https://www.yeasen.com/products/detail/5444 |
|
CHO HCP ELISA检测试剂盒 |
36714ES https://www.yeasen.com/products/detail/5842 |
翌圣生物定制化HCP试剂盒开发服务
鉴于HCP检测的重要性,翌圣生物以高性能单克隆抗体研发平台为依托,建立了蛋白抗体关键原料研发平台和独立的免疫检测产品开发实验室,并配备了先进研发仪器设备,如:酶标仪和2D-WB双向凝胶电泳-免疫印迹仪等。研发平台已经非常成熟,可以快速完成哺乳动物细胞、昆虫细胞(如Sf9)、细菌和酵母等多种宿主细胞残留蛋白(HCP)试剂盒定制服务。
宿主细胞残留蛋白检测试剂盒定制服务,周期6~10个月。
抗原抗体制备:确定HCP抗原、建立HCP参考品、制定免疫路径和策略、制备HCP抗体等,周期通常4~6个月;
试剂盒开发:抗体优化、覆盖率分析、试剂盒方法验证等,周期通常2~4个月。
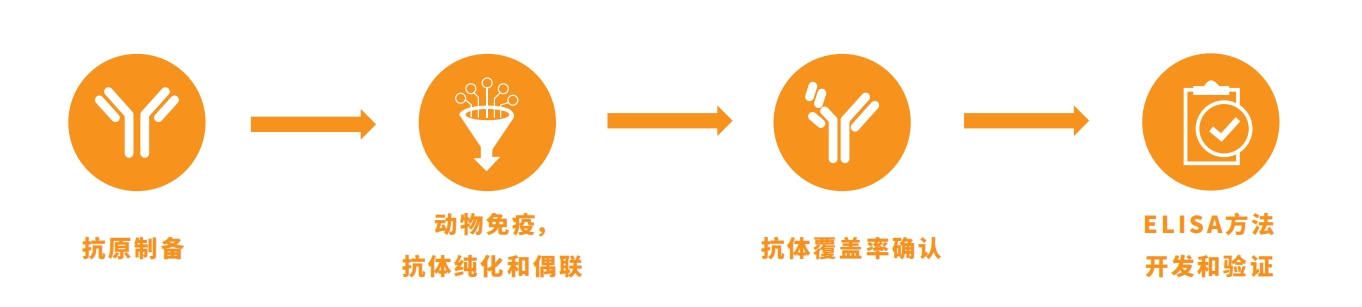
翌圣生物HCP抗体覆盖率验证服务
已知,ELISA法是行业内检测HCP残留的金标准,然而该方法的准确性取决于多克隆抗体对HCP的覆盖率。《美国药典》和《欧洲药典》中提到免疫亲和纯化、2D-WB是表征HCP ELISA抗体及其覆盖率的推荐方法。
2D-WB首先采用二维凝胶根据大小和电荷分离蛋白质,然后将这些蛋白质转移到膜上与 HCP 抗体一起孵育以进行蛋白质印迹检测。
翌圣生物拥有全套2D-WB仪器设备和丰富的实验室操作经验,可针对CHO、E.coli、HEK293等宿主细胞的HCP样品,提供抗体覆盖率验证服务。
参考文献:
[1]USP <1132> Residual Host Cell Protein Measurement in Biopharmaceuticals.
[2]USP <1132.1> Residual Host Cell Protein Measurement in Biopharmaceuticals by Mass Spectrometry.
[3]EP-2.6.34. Host-Cell Protein Assays.
[4]2020版《中国药典》3412大肠埃希菌菌体蛋白质残留量测定法、3413假单胞菌菌体蛋白质残留量测定法、3414酵母工程菌菌体蛋白质残留量测定法。
