宿主细胞蛋白HCP残留检测试剂盒强势登场!
宿主细胞蛋白(HCP)介绍
HCP,Host Cell Protein是指在生产治疗性蛋白质药物时,宿主细胞(如细菌、酵母、哺乳动物、昆虫或植物细胞)所产生的一种蛋白质混合物。这种混合物可能会残留在治疗性蛋白质药物产品中,具有潜在的免疫原性,因此可能会影响药物产品的质量、安全性和有效性。因此,对于HCP的去除水平需要建立合适的监测策略,并控制终产品中HCP的含量以符合药物质量的要求。
HCP的危害
免疫原性
HCP是具有多种生理化学和免疫学特性的复杂混合物,可能会触发Toll-Like受体介导的先天免疫反应,或者直接由宿主细胞产生的细胞因子刺激机体,产生组胺,发生炎症反应。因此几乎所有HCP都有作为外来蛋白药物的临床安全风险。
佐剂效应
HCP可以作为佐剂增加机体对治疗蛋白的免疫反应,及产生抗抗体“ADA”,从而直接影响药物在生物分布,药代动力学和生物活性。
产品稳定性
某些具有蛋白水解活性的HCP,如果未充分去除或失活,也会影响药品的稳定性和功效。例如宿主细胞产生的蛋白酶,直接与某些抗体的降解有关。
相关法规监管要求
2020年版中国药典三部各论中显示,HCP标准为占总蛋白含量要小于0.05%。
FDA要求用一种灵敏度较高的方法检测药品中的HCP,其含量应该低于检测限(通常小于100ppm)。
欧洲药典中规定,在生物制品中,HCP的含量应当小于0.1%。
由此可见,监管机构对于HCP的要求是高度一致的,生物制品的工艺开发必须经过HCP检测,并证明纯化工艺能够将HCP降低到安全水平,一般要求每毫克药物HCP应当控制在纳克范围内。
HCP ELISA检测试剂盒产品简介
ELISA法是一种使用简单、灵敏度高且客观的HCP检测方法。翌圣生物科技(上海)股份有限公司自主研发的一款能够检测使用了宿主细胞进行转染以及蛋白表达的各生物制品下游纯化过程样品以及终产品中宿主蛋白残留量的试剂盒。本试剂盒利用双抗夹心酶联免疫检测(ELISA)的实验原理,以及生物素-链霉亲和素放大系统,能够高灵敏的检测样本中HCP残留量。试剂盒可以用于生物制品纯化工艺过程的优化、中间工艺过程的杂质控制以及终产品的放行检测。
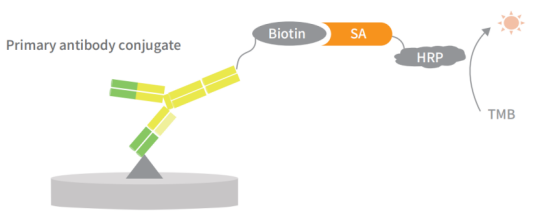
图1.HCP ELISA检测原理
产品优势
-
符合法规:按照Chp、USP、ICHQ2(R1)等要求进行全面验证;
-
保障品质:包被和检测抗体、标准品等原材料全自主研发,可溯源;
-
配合审计:生产工艺稳定,批间差可控,有完善的审计文件;
-
灵敏度高:定量下限(LLOQ)可低至3.125 ng/mL水平;
-
专属性强:高特异性,不受其他外源蛋白的干扰。
产品推荐
|
宿主细胞残留蛋白检测 |
货号 |
规格 |
|
36712ES |
48T/96T | |
|
36713ES |
48T/96T | |
|
36720ES |
48T/96T | |
|
36721ES |
48T/96T |
