荧光定量PCR之引物扩增效率
上期给大家分享了qPCR引物设计的方法。那么在后续的qPCR实验中如何去评判设计的引物是否符合实验需求呢?在国际公认的MIQE (Minimum Information for Publication of Quantitative Real-Time PCR Experiments)指南中关于qPCR引物有明确的规定,引物的扩增效率是必须提供的参数(E)之一。所以本期主要向大家介绍引物扩增效率的检测方法。
检测引物扩增效率前有两个条件:第一个是需要挑选一款性能优良的qPCR试剂,一般可通过检测灵敏度、精确度、线性范围等判断qPCR试剂的性能。第二个是需要质量好的模板。模板质量的评价指标有纯度和完整性,可通过吸光度和电泳检测确认。在保证qPCR试剂和模板质量好的前提下,我们就可以进行引物扩增效率的检测了。引物扩增效率需通过制作标准曲线的方法进行评估。
标准曲线制作方法
制作标准曲线首先需要选择标准品。为了保证标准品和待测样品有一致的扩增效率,标准品与待测样品应有较高的同源性。比如,待测样品是cDNA,可选择cDNA作为标准品。若待测样品是gDNA,可选择gDNA作为标准品。下面分别介绍未知浓度的标准品(以cDNA为例)和已知浓度的标准品(以质粒DNA为例)标准曲线的制作方法。
-
未知浓度的标准品标准曲线制作方法:(以cDNA标准品为例)
一、模板
稀释:
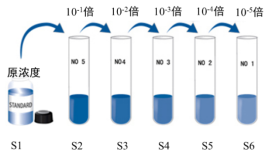
将反转录的cDNA如下图所示进行10倍梯度稀释,6个梯度,依次设置为S1-S6。
二、qPCR反应体系配制
以Hieff® SYBR Green为例,配制方式可参照下表,反应体系为20μL。需注意,应根据所使用的定量仪器型号选择相应浓度的校正染料ROX,具体选择方式可参考产品说明书。
|
S1-S6 |
NRT*1 |
NTC*2 |
|
|
Hieff® qPCR SYBR® Green Master Mix |
10 μL |
10 μL |
10 μL |
|
Forward Primer (10μM) |
0.4 μL |
0.4 μL |
0.4 μL |
|
Reverse Primer (10μM) |
0.4 μL |
0.4 μL |
0.4 μL |
|
梯度稀释的模板 |
1 μL |
- |
- |
|
RNA |
- |
1 μL |
- |
|
无菌超纯水 |
to 20 |
to 20 |
to 20 |
【注】*1、NTC阴性对照(No Template Control),是以水为模板的对照,用于确认是否产生引物二聚体和体系中是否有模板污染。
*2、NRT阴性对照(No reverse transcriptase control),是指在反转录过程中不加入反转录酶得到的样品为模板,用于确认是否含有gDNA污染。
三、样品设置
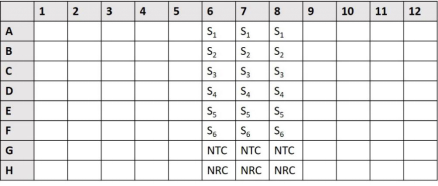
qPCR反应体系配制完成后,可参照下表进行样品设置,每个样品均设置3个技术性重复。
四、qPCR反应程序设置
以ABI 7500为例,qPCR反应程序可参照下表进行设置。此外,荧光标记方式应选择SYBR Green,参比染料需选择ROX。
|
预变性 |
95℃ |
5 min |
|
循环反应(40 cycles) |
95℃ |
10 sec |
|
60℃ |
34 sec |
|
|
融解曲线 |
95℃ |
15 sec |
|
60℃ |
60 sec |
|
|
95℃ |
15 sec |
五、标准曲线制作:
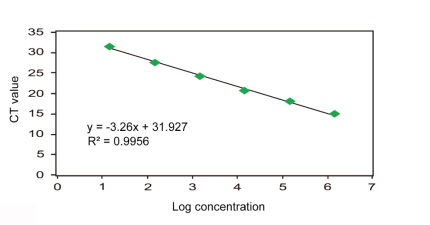
qPCR反应结束后,以模板系列浓度倍数log值为X轴,以对应的Ct值为Y轴(反之亦可),制作标准曲线,如下图。
-
已知浓度的标准品标准曲线制作方法:(以质粒DNA标准品为例。)
质粒DNA是含有目的片段的克隆载体。一般是通过PCR扩增目的片段,然后将目的片段插入克隆载体中,提取重组质粒,待测序正确后即可作为标准品。质粒DNA量可用Nanodrop等仪器测定,通过拷贝数换算公式转换成具体的质粒拷贝数,最后进行倍比稀释备用。
拷贝数计算公式:拷贝数=(质量÷相对分子质量)×6.02×1023。
具体的操作方法与实验设置同未知浓度标准品标准曲线制作方法。
扩增效率的计算
制作完标准曲线后,需要对其进行评估,评估指标有两个,相关系数R2和扩增效率(E)。相关系数R2反应了数据的线性关系,主要用来评估重复样品的可重复性和不同浓度的初始模板是否具有相同的扩增效率。R2值应大于0.98,该值越接近1,表示线性关系越好,数据越准确。
扩增效率(E)计算公式:E=10-1/斜率-1。
扩增效率(E):一般认为扩增效率应介于90~110%之间,与之相对应的斜率介于-3.58~-3.1之间。
常见问答
|
问题 |
可能原因 |
解决方案 |
|
扩增效率偏低 |
1)引物设计不当。 2)实验反应条件不佳。 |
首先通过降低退火温度,延长延伸时间,提高引物浓度或改成三步法qPCR等方式进行优化。若效果仍不好,重新设计引物。 |
|
扩增效率偏高 |
1)非特异性产物扩增。 2)加样错误。 |
1)首先通过提高退火温度,减少延伸时间或降低引物浓度等方式进行优化。若效果仍不好,重新设计引物。 2)规范实验操作。 |
|
线性关系差 |
标准品加样错误或降解。 |
检测标准品是否降解,规范实验操作。 |
|
NTC有扩增 |
1)引物二聚体。 2)体系或操作环境有外源DNA污染。 |
1)降低引物浓度或重新设计引物。 2)在超净工作台中操作,将反应体系组分逐一做平行对比实验,找出污染源。 |
|
NTC无扩增,NRC有扩增 |
RNA模板有gDNA残留。 |
建议用DNase I消化RNA模板。 |
|
无扩增曲线。 |
未收集荧光信号。 |
重新实验,在延伸阶段收集荧光信号。 |
本期关于引物扩增效率的问题我们就介绍完了,如果您还没有检测过引物的扩增效率,那就赶快按照小编的检测方法操练起来吧~
关于更多qPCR实验相关内容,我们下期见
