涨知识|克隆专题四:分子克隆连接方法
克隆技术,又称为“生物放大技术”,目前应用最广泛的技术为“分子克隆”,即通过重组技术将目的DNA片段按照人们的设计定向连接起来,在特定的受体细胞中与载体同时复制并得到表达,产生新的遗传性状的技术。
大部分的分子克隆方法,诸如传统分子克隆、TA克隆、Gatway克隆、TOPO克隆、无缝克隆等都绕不开目的片段制备、载体制备、连接、转化、筛选等等步骤。其中,载体和片段连接的方法是分子克隆的核心步骤,接下来小翌就具体解析一下载体和片段连接的过程,为您的实验提供好方法。
根据市面上主要的分子克隆技术,载体与片段的连接过程可分为依赖连接酶的连接、依赖修饰酶的连接以及依赖重组酶的连接。
依赖连接酶的连接
DNA连接酶是一种能够封闭DNA链上缺囗的酶,它借助ATP或NAD水解提供的能量催化DNA链的5'-磷酸基端与另一DNA链的3'-羟基端生成磷酸二酯键。根据酶的腺苷酰化依賴不同可分为不同的连接酶:依赖NAD的连接酶和依赖ATP的连接酶。最早发现的DNA连接酶都依赖NAD水解提供能量,直到1970年首次发现能借助ATP提供能量的DNA连接酶——T4 DNA连接酶(T4 DNA ligase,T4 Lig),由病毒基因组编码而成,主要从缺失型噬菌体中提取,噬菌体T4的30基因是该酶的合成基因。该连接酶应用最为广泛,如翌圣T4 DNA连接酶(Cat#10300ES)。
连接反应由三步完成:
T4 DNA ligase先由ATP供能产生E-AMP复合物;
E-AMP复合物识别双链DNA切口位置,将AMP转移到5'-P基团,形成5'-P-AMP复合物;
3'-OH亲核攻击5'-P-AMP形成磷酸二酯键,并释放出AMP。
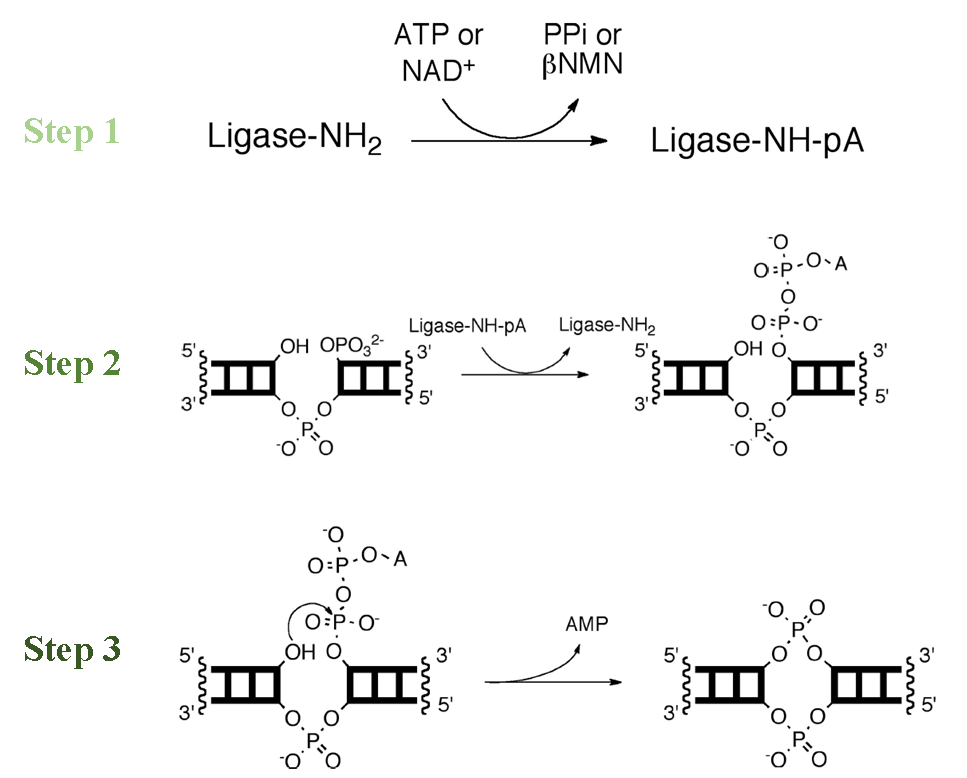
图1. T4 DNA连接酶的作用原理【1】
利用目前已知的T4连接酶的连接特点,在具体的基因工程操作中,科研人员对DNA片段的连接方法分为以下三种:
连接dsDNA的粘性末端
用限制性核酸内切酶酶切,形成具有黏性末端的DNA片段,利用DNA连接酶直接连接;
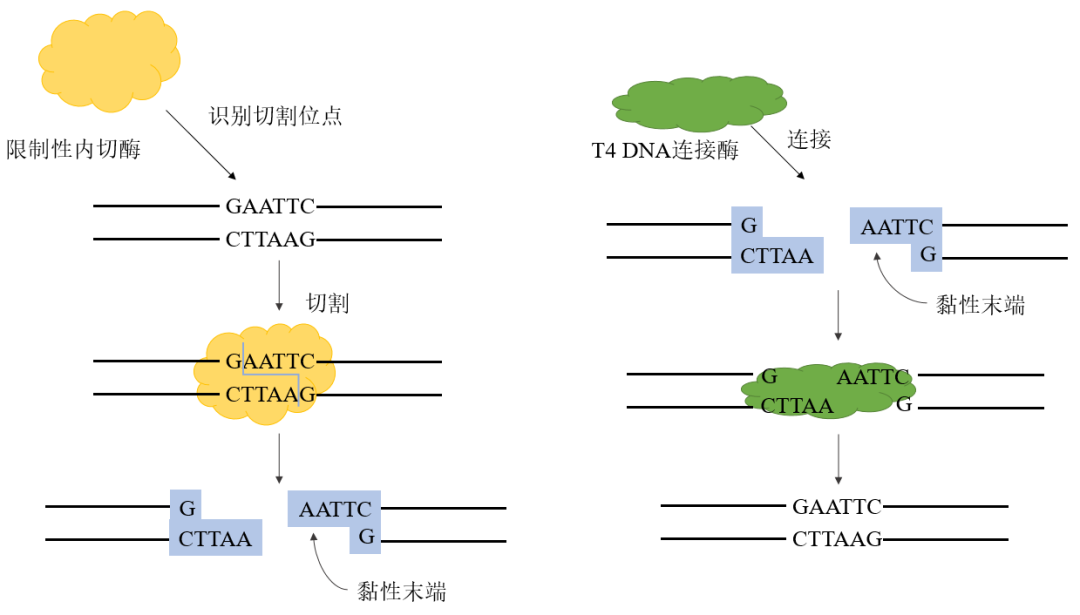
图2. 粘性末端酶切连接
连接平末端
对于平末端的DNA片段的连接常利用T4 DNA连接酶连接;
连接人为合成的粘性末端
在DNA片段末端加上poly(dA)-poly(dT)尾,或化学合成的衔接物或接头,使之形成黏性末端之后,再用DNA连接酶将它们连接起来。如翌圣普通PCR试剂盒(Cat#10102ES、Cat#10103ES、Cat#10157ES)等,含有Hieff® Taq DNA Polymerase(Cat#10101ES),使得扩增产物末端具有3’-dA,可通过T4连接酶直接用于TA克隆或者NGS接头连接。
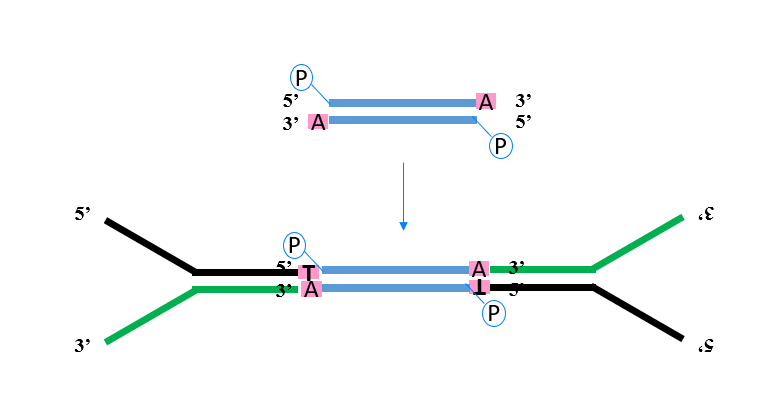
图3. NGS文库构建中接头的连接
依赖修饰酶的连接
这类连接技术不受限制性内切酶酶切位点的限制,而是通过DNA修饰酶进行载体和片段的连接。该技术克服了低连接效率和受限制性内切酶酶切位点限制的问题,使得基因克隆更加灵活,更具有可操控性。
Aslanidis和de Jong于1990年提出不需要限制性内切酶和T4 DNA连接酶的克隆连接法,即利用T4 DNA聚合酶的3'→5'核酸外切活性,切割片段和载体,产生12个碱基的5'突出互补末端,利用突出的互补末端之间的退火复性进行基因连接。

图4. 不依赖连接反应的克隆法【4】
其中,拓扑异构酶是被研究得最详细的DNA修饰酶,它分为拓扑异构酶I和拓扑异构酶II。拓扑异构酶I催化DNA单链的断裂和重新连接,不需要能量辅助因子如ATP或NAD。拓扑异构酶II能同时断裂并连接DNA双链,通常需要能量辅助因子ATP。
翌圣TOPO克隆试剂盒(Cat#10906ES、Cat#10907ES、Cat#10909ES),含有拓扑异构酶,该酶通过磷酸键偶联在TOPO载体的两端,在连接反应中,受插入片段的5'端羟基的攻击,磷酸键释放能量。利用该能量,插入片段5'端羟基与载体片段3'端磷酸基团连接在一起,Topo异构酶从载体分子上脱落,仅需5 min就能完成连接反应。
依赖重组酶的连接
重组酶最早应用于Gateway技术中,它能够识别、切割特异的重组位点,并连接两个参与重组的载体和片段。目前应用最为广泛的技术是Gibson Assembly,原理是通过外切酶产生黏性末端,再通过同源重组酶的连接得到重组片段。
翌圣同源重组克隆试剂盒(Cat#10911ES、Cat#10922ES),预混了重组酶和重组反应所需缓冲液,并添加了独特的重组增强因子,可显著提高重组克隆效率。通过PCR产物两端便分别带上15-20个与载体序列同源性的碱基,依靠碱基间作用力互补配对成环,不经过酶切,PCR产物和线性化载体在同源重组酶的作用下,经过一定的时间和温度即可进行转化,完成定向克隆。
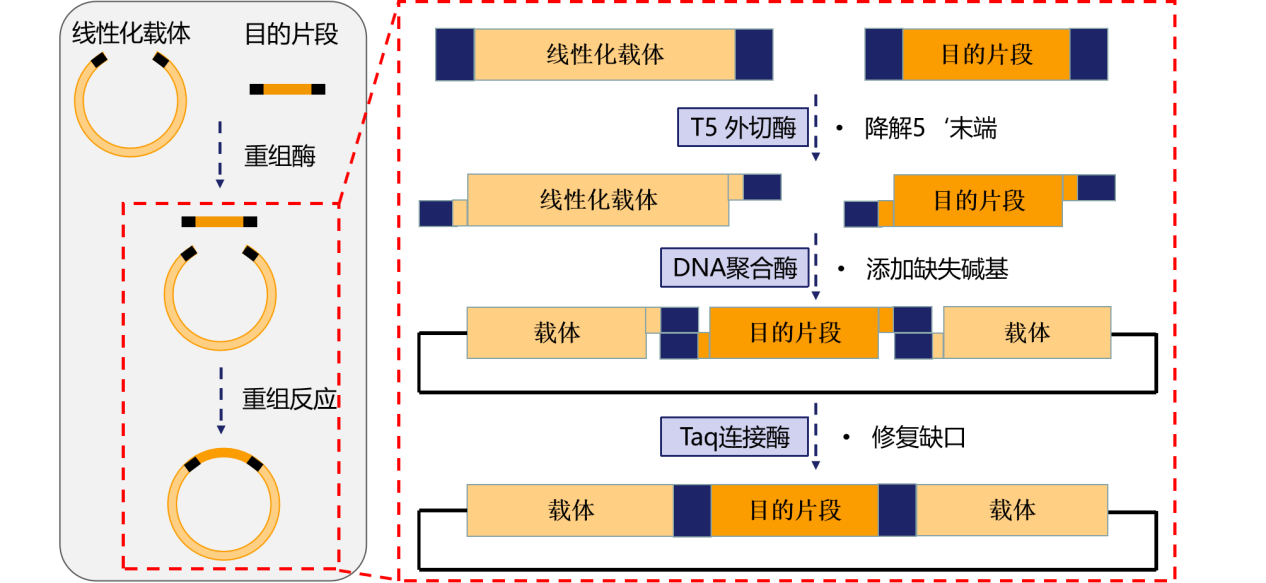
图5. 同源重组原理
通过连接反应,目的片段和载体已连接组合在一起,成为新的重组DNA质粒。为了表达克隆的目的基因片段,需要将重组质粒导入到大肠杆菌等细胞中,即进行下一步实验——转化。那么转化步骤中应用到的技术和试剂又有哪些呢?关注我们,小翌会在下一期的分子克隆技术专题中给大家具体讲解转化技术,为您的实验带来新的思路与方向,期待下一次的见面~
相关产品列表
|
产品定位 |
产品名称 |
产品货号 |
规格 |
|
T4连接 |
Hieff® Gold T4 DNA Ligase |
1000 U |
|
|
快速PCR,快至1s/kb |
2×Hieff® Ultra-Rapid HotStart PCR Master Mix(with Dye) |
1 mL/5×1 mL |
|
|
常规PCR |
2×Hieff® PCR Master Mix(With Dye) |
1 mL/5×1 mL |
|
|
常规PCR,不含染料 |
2×Hieff® PCR Master Mix(No Dye) |
1 mL/5×1 mL |
|
|
兼容TA/平末端克隆 |
Hieff Clone® Universal Zero TOPO TA/Blunt Cloning Kit |
5 T/20 T |
|
|
TOPO克隆-TA末端 |
Hieff Clone® Zero TOPO-TA Cloning Kit 零背景TOPO-TA克隆试剂盒 |
20 T |
|
|
TOPO克隆-平末端 |
Hieff Clone® Zero TOPO-Blunt Cloning Kit |
20 T |
|
|
单片段一步克隆,已发文章累计IF达到1000+ |
Hieff Clone® Plus One Step Cloning Kit一步法快速克隆试剂盒 |
20 T/50 T |
|
|
1-6片段一步克隆,最快5分钟完成重组反应 |
Hieff Clone® Universal One Step Cloning Kit通用型一步法快速克隆试剂盒 |
20 T/50 T |
参考文献
1.Lohman G J S , Chen L , Evans T C . Kinetic Characterization of Single Strand Break Ligation in Duplex DNA by T4 DNA Ligase[J]. Journal of Biological Chemistry, 2011, 286(51):44187-44196.
2.Anderson HJ, Roberge M. DNA topoisomerase II: a review of its involvement in chromosome structure, DNA replication, transcription and mitosis. Cell Biol Int Rep 1992; 16(8): 717–724.
3.Kunze N, Yang GC, Dolberg M, Sundarp R, Knippers R, Richter A. Structure of the human type I DNA topoisomerase gene. J Biol Chem 1991; 266(15): 9610–9616.
4.Aslanidis C, de Jong PJ. Ligation-independent cloning of PCR products (LIC-PCR). Nucleic Acids Res, 1990, 18(20): 6069-6073.
