涨知识|qPCR专场六:一文读懂qPCR文章金标准-MIQE
荧光定量PCR实验因为灵敏度高所以经常是差之毫厘谬以千里,所以在实验过程中,我们需要注意诸多细节,谨慎操作。小伙伴们看到这里就要着急了,我怎样才能做好qPCR实验,拿到实验结果,发表高分文章,走上人生巅峰呢?

2009年,Stephen A等人发表文章《The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments》,这是一群qPCR大牛经过商讨制定的qPCR实验和发表文章指南,其目的是为了作者根据指南提供相关的实验条件和实验特点,审稿人据此可以评价实验所用方法的可靠性,其他研究人员也可以利用这些信息进行重复实验。
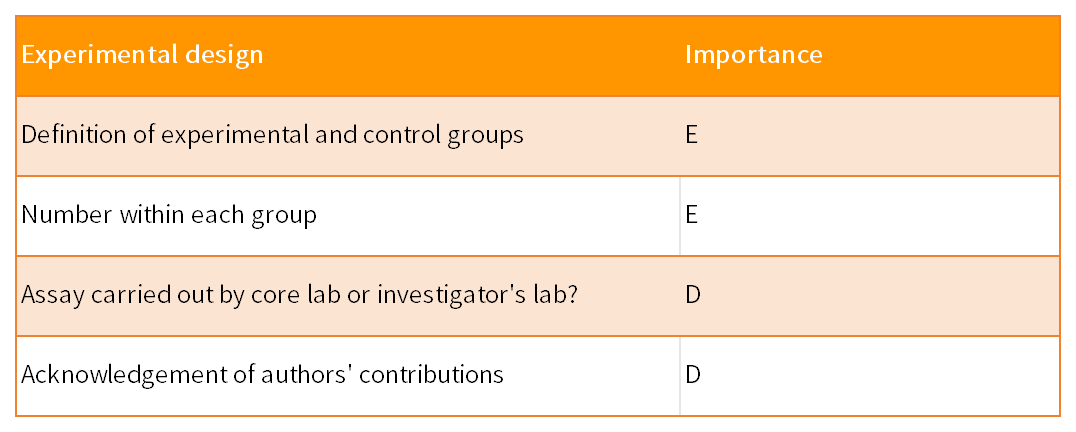
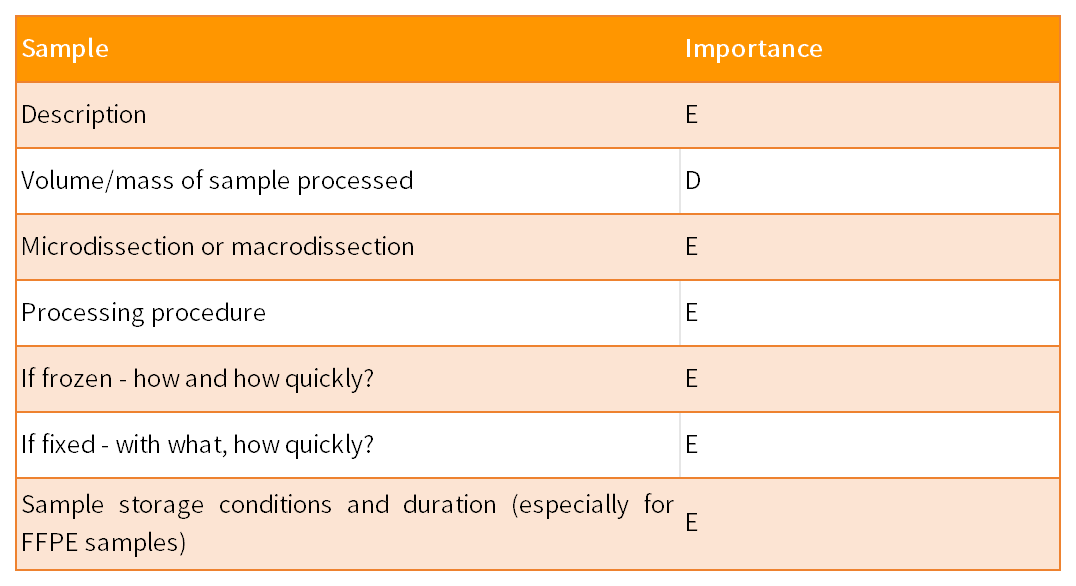
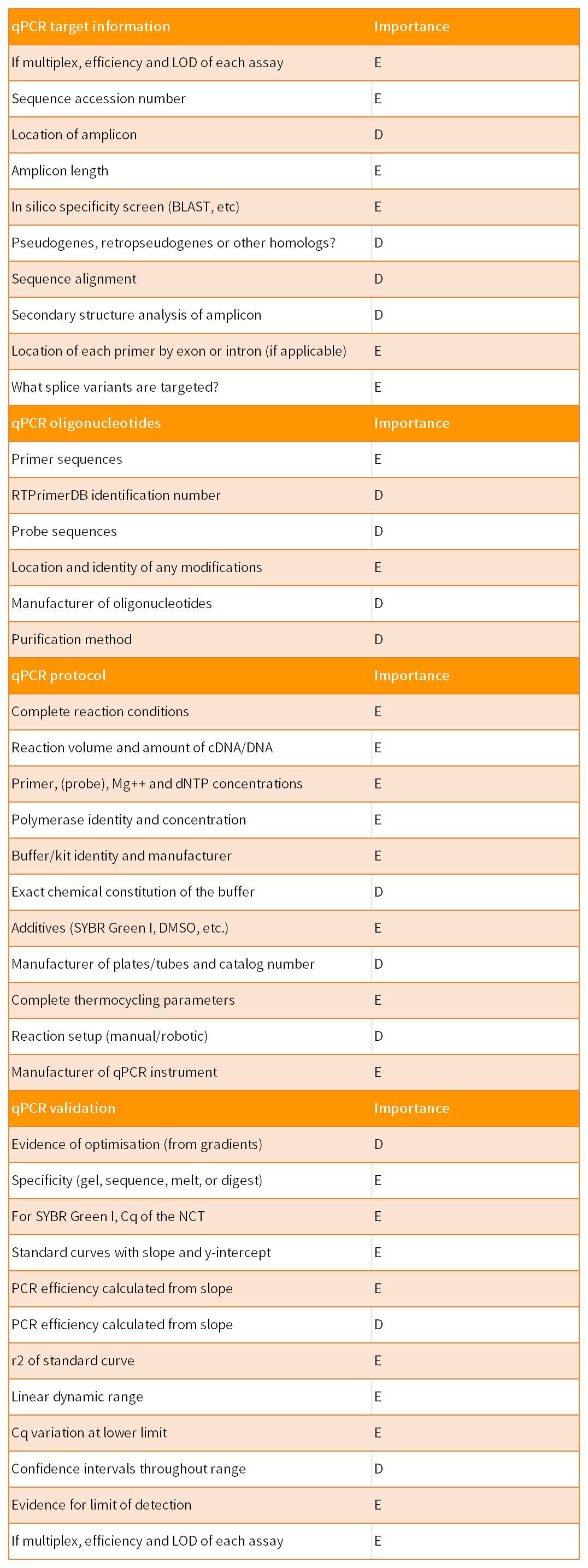
MIQE指南由9个部分组成,共涉及85个参数,以保证qPCR实验的实用性、准确性和可重复性。这9 部分包括实验设计、样本、核酸提取、反转录、靶标基因、qPCR引物和探针、qPCR实验报告、qPCR合理性和数据分析。85个参数针对qPCR结果的重要性,分为了两类:其中标记为“E”表示必须(essential),标记为“D”表示建议(desirable)。
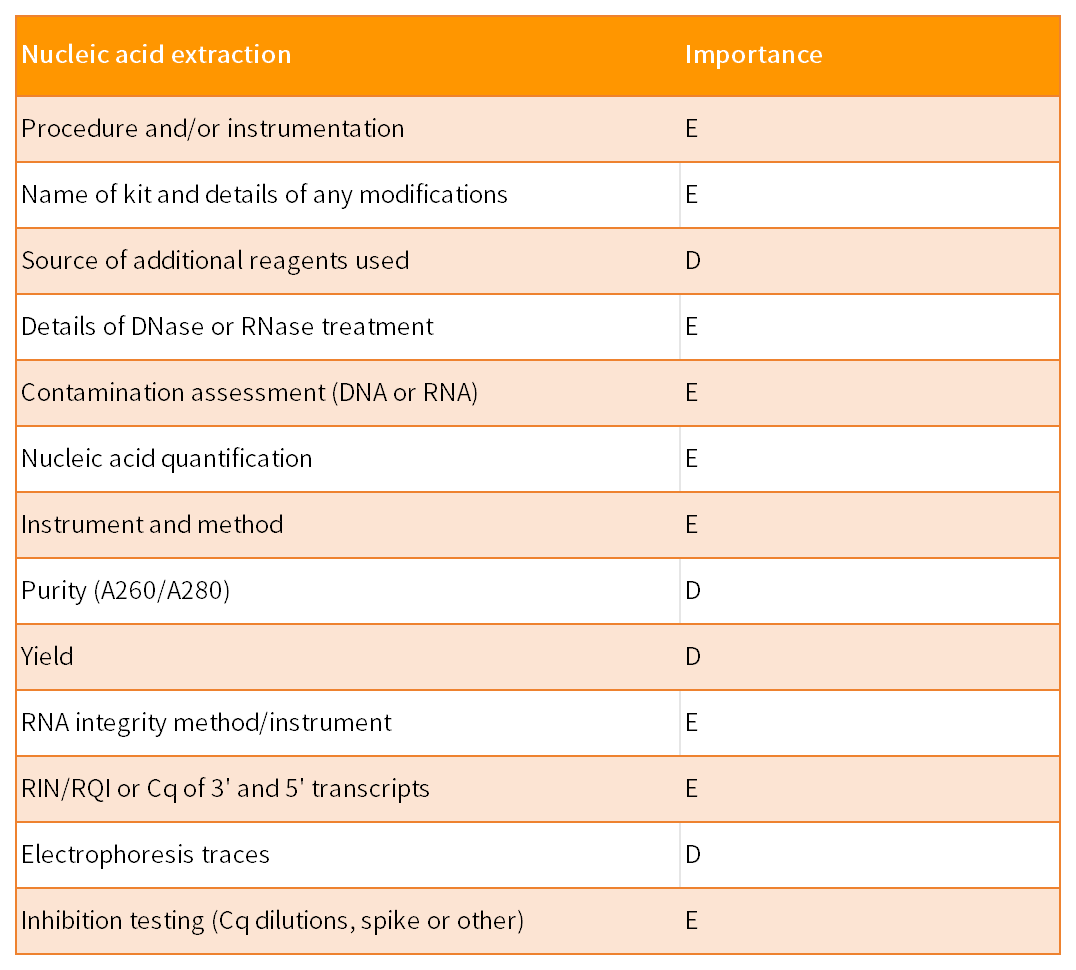
针对提取得到的RNA等核酸进行量化十分重要,尤其是在比较分析不同样本时,RNA等核酸投入一致或类似的数量能够避免一系列不确定因素。另外RNA等核酸的质量评估也必不可少。常见的量化和质量评估方法有多种,最为常见的是分光光度法,但需要注意的是A260/A280比值必须在中性PH值buffer中进行测量,吸光度比值会受到DNA或者残余苯酚的影响而改变且不能评估核酸是否发生降解,故最好搭配其他检测方法,例如琼脂糖凝胶电泳、或者是参考基因/靶基因3‘:5’完整性检测。如果RNA样本部分降解,该信息在发表文章时需要告知,因为低水平转录检测的敏感性可能降低,其中降解带来的差异可能会造成不同的实验结论。
RNA提取过程中也应包括DNA酶处理步骤,用以去除相关的基因组DNA污染。建议对RNA样本是否经过DNA酶处理(包括DNase类型和反应条件)等做好记录。
核酸中杂质残留的检测应通过稀释样本做反转录以检测反转录活性或PCR抑制程度,或者采用SPUD等抑制实验。
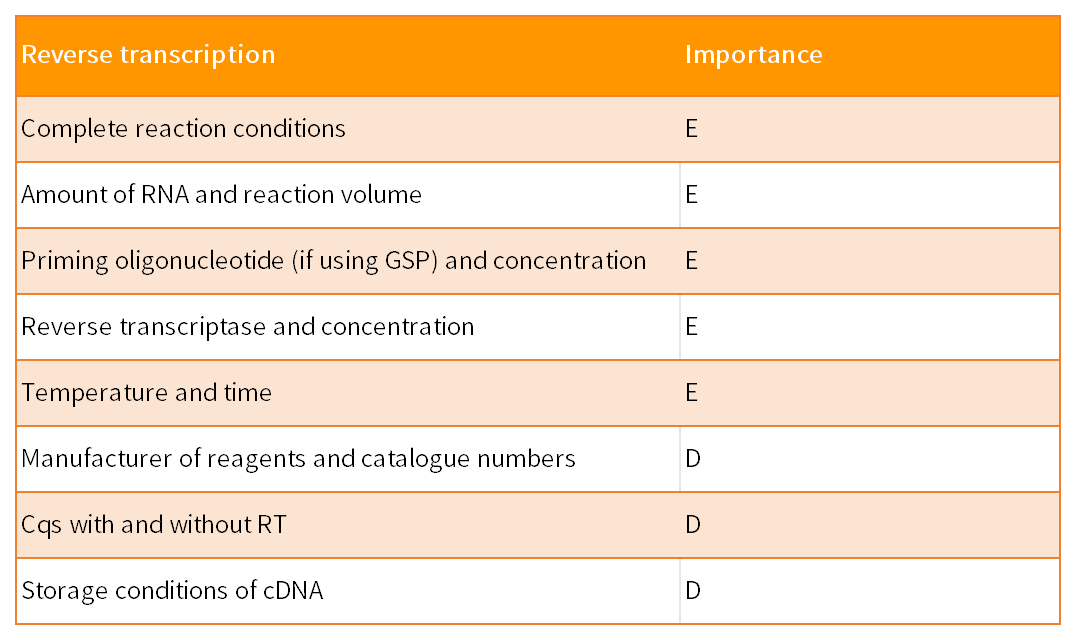
核酸的结构(例如茎环二级RNA结构)对于反转录和PCR的效率有着重要的影响。故而引物、探针和PCR扩增产物的位点需考虑到RNA的折叠。
引物的特异性需用直接的实验数据验证有效性,例如凝胶电泳、熔解曲线、DNA测序、扩增子大小、和/或限制性酶切验证。一些引物优化的证据或方案最好也可提供,理想的形式是退火温度梯度或Mg2+浓度梯度摸索并以Cq值、荧光与循环曲线图的形式呈现数量和/或熔解曲线。
所有qPCR反应都需要进行额外的质控或定量标准品,例如使用NTC检测PCR污染。每96孔板或每批样品上样应包括NTC,并确定数据不符合的条件,举个例子,如果未知最低浓度的Cq值为35,则可以忽略Cq值≥40的NTC。
4.1扩增效率
稳定和精确的荧光定量PCR检测通常和高效的扩增效率相关。尤其当检测经内参基因校准的目的基因mRNA浓度时,扩增效率尤为重要。△△Cq法是测定样品间不同基因表达情况最常用的方法之一,是基于单个内参基因的校准进行的。计算靶标基因和内参基因的Cq值的差异,并直接比较不同样本之间的△Cq,这种情况需要两个基因能以可比的效率进行扩增,方能进行比较。
扩增效率必须通过标准曲线来确定,因为这种校准方法提供了一个简单、快速以及可重复扩增效率、分析敏感性和实验稳定性的平均指标。扩增效率根据标准曲线对数线性部分的斜率确定。每个靶标基因的的标准曲线需提交在稿件中,这样审稿人能够看到。
4.2线性动态范围
根据生成的标准曲线的模板,动态范围应至少包括3个数量级,理想状态是5或6 Log10浓度。标准曲线的线性区间需包括被定量的靶标基因的区间。由于定量下限通常定义不明确,应当确定线性区间内最低浓度的变化。同时需要展示相关系数(R2 值)
4.3灵敏度(LOD)
LOD的定义是可以检测到95%的阳性样品的最低浓度。换言之,在一组含有目的基因的重复实验中,在LOD浓度下,不应发生超过5%的失败反应。实际上,我们可以通过有限稀释法来检测,失败和成功反应的百分比覆盖泊松分布即可。
4.4精度
荧光定量PCR结果的变化有多种原因,包括温度的差异可影响退火或变性,移液误差引起的浓度差异和随机变化。qPCR精度和浓度相关,一般随着拷贝数的降低而降低。理想情况下,实验内的重复性应当以SD error bar或具有重复样品的标准曲线上的CIs的形式显示在图中。CVs不应与Cqs一起使用,但可用于表达拷贝数或浓度的差异。
多重实验大大扩展了qPCR分析的能力,特别是应用于同时检测点突变或多态性检测。多重荧光定量PCR实验需要证明多个靶标的准确量化在同一管中不会受到干扰,即,扩增效率和灵敏度和进行单重实验时是一致的。这点当丰度较低的靶标基因和丰度高的靶标基因进行共同扩增时尤为重要。
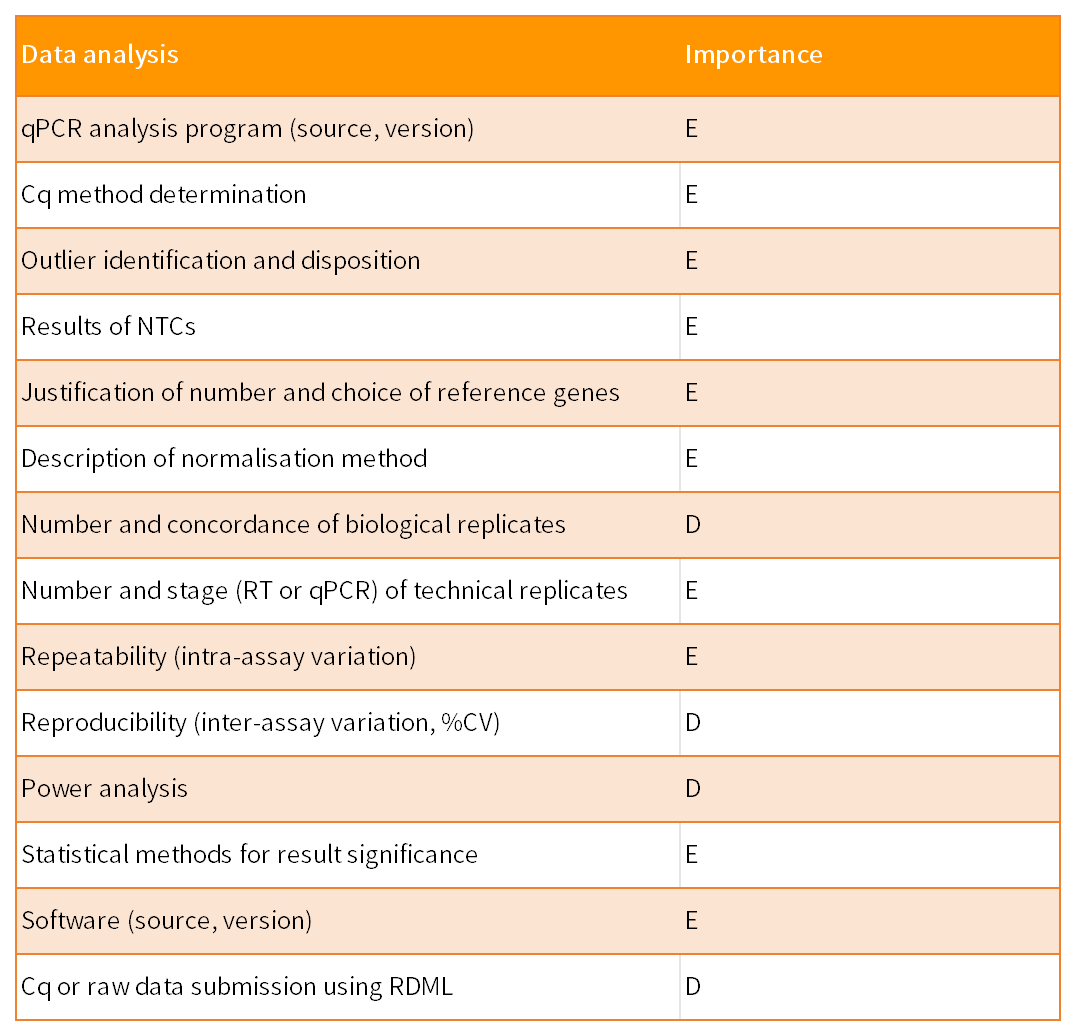
数据分析包括对原始数据的检查、对数据质量和可靠性的评估,以及生成可报告的结果。
均一化是进行科学qPCR分析的一个重要组成部分,该过程控制核酸抽提效率、反转录效率和扩增效率的变化,从而能够比较不同样本的RNA浓度。使用内参基因作为内部对照是最常见的均一化RNA数据的方法。均一化包括靶标基因和内参基因的RNA浓度之比。内参基因的RNA应稳定表达,其基因丰度与样品中mRNA总量呈现强相关。
均一化通常不能用一个内参基因,除非作者可为审稿人提供明确的证据证实内参基因在其实验条件下表达恒定。内参基因的最佳数目和选择需通过文章具体实验确定并报告方法。
生物体本身固有的变异性可能与组间的实验差异相匹敌,甚至超过后者。尤其是使用许多生物学重复来提高实验的统计学重要性时,这种变化就变得显而易见。虽然生物重复间的差异可能很大,但是足够数量的样本可以减少实验差异性。许多因素会导致实验变异,从而影响到达统计所需的生物重复的数量。因此,功效分析(power analysis)有助于确定有效可靠结论所需的样本数。
使用PCR仅检测核酸是否存在,而不是对其进行准确定量,被称为定性PCR,该方式广泛应用于病原体诊断。PCR方法定性/定量分层问题在于,准确回答是或否,需要低敏感性PCR实验的敏感性信息。因此,即使是定性分析也应提供有关分析能力的相关信息。
建议将缩写qPCR用于real-time PCR,并将RT-qPCR用于反转录-qPCR。将RT-PCR简称为qPCR会引起混淆,并且与传统RT-PCR的应用不符。
内参基因
内参基因应当指的是参照基因(reference genes),而不是管家基因(housekeeping genes)。
TaqMan探针应指为水解探针(hydrolysis probes)。
FRET probe (fluorescence resonance energy transfer probe, 荧光共振能量转移探针)指的是一种机制,指发射/猝灭依赖于两个荧光染料分子的电子激发态之间相互作用。LightCycler型探针指的是双杂交探针(dual hybridization probes) 。
牛津英语词典只列出了定量(quantification),非定量(non-quantification),因quantification是恰当的,而不是quantitation。
现在文献中使用的阈值循环(threshold cycle, Ct),交点(crossing point, Cp)和分支点(take-off point, TOP) 与PCR循环的术语不一致。这些术语指的实际上是相同的值,只是由于不同仪器厂家由于产品差异化的原因造成的,不具有科学的准确性和清晰性。根据RDML(Real-Time PCR Data Markup Language)数据标准,建议统一使用定量循环(quantification cycle, Cq)这个术语。
|
方法 |
分类 |
产品名称 |
货号 |
|
RNA提取 |
同Trizol提取 |
TRIeasy™ Total RNA Extraction Reagent |
|
|
动物组织/细胞总RNA提取,避开有毒试剂,最快15 min完成 |
MolPure® Cell/Tissue Total RNA Kit细胞/组织总RNA提取试剂盒 |
||
|
简单植物总RNA提取,避开有毒试剂,最快40min完成 |
MolPure® Plant RNA Kit 植物RNA提取试剂盒 |
||
|
多糖多酚植物总RNA提取,最快30min完成 |
MolPure® Plant Plus RNA Kit 多糖多酚植物RNA提取试剂盒 |
||
|
细胞总RNA提取,避开有毒试剂,最快8 min完成 |
MolPure® Cell RNA Kit 培养细胞RNA提取试剂盒 |
||
|
qPCR染料法 |
高灵敏通用型定量预混液(染料法) |
Hieff UNICON® Universal Blue qPCR SYBR Master Mix |
|
|
超高性价比定量预混液 (染料法),已发文章累计IF达到5000+ |
Hieff® qPCR SYBR Green Master Mix (No Rox) |
||
|
Hieff® qPCR SYBR Green Master Mix (Low Rox) |
|||
|
Hieff® qPCR SYBR Green Master Mix (High Rox) |
|||
|
高灵敏型qPCR预混液(染料法) |
Hieff UNICON® qPCR SYBR Green Master Mix (No Rox) |
||
|
Hieff UNICON® qPCR SYBR Green Master Mix (Low Rox) |
|||
|
Hieff UNICON® qPCR SYBR Green Master Mix (High Rox) |
|||
|
miRNA加A法高特异性定量预混液(染料法) |
Hieff® miRNA Universal qPCR SYBR Master Mix(加A法) |
||
|
miRNA茎环法高特异性定量预混液(染料法) |
Hieff® miRNA Universal qPCR SYBR Master Mix(茎环法) |
||
|
高灵敏一步法反转定量试剂盒(染料法) |
Hifair® III One Step RT-qPCR SYBR Green Kit |
||
|
细胞直扩RT-qPCR,1.5 h从细胞到基因表达分析(染料法) |
Hieff® Fast Cell Direct SYBR Green RT-qPCR Kit |
||
|
反转录试剂 |
5 min快速反转,最长可满足14 kb cDNA合成,含gDNA去除(下游应用PCR/qPCR)-示踪版New |
Hifair® AdvanceFast 1st Strand cDNA Synthesis Kit |
|
|
5 min快速反转,最长可满足14 kb cDNA合成,含gDNA去除(下游应用PCR/qPCR)-常规版New |
Hifair® AdvanceFast 1st Strand cDNA Synthesis Kit(No Dye) |
||
|
15 min一步完成gDNA去除与反转录(下游应用qPCR) |
Hifair® V one-step RT-gDNA digestion SuperMix for qPCR |
||
|
高质量第一链cDNA合成预混液,含gDNA去除(下游应用qPCR) |
Hifair® III 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus) |
||
|
最长可满足19.8 kb cDNA合成试剂盒,含gDNA去除(下游应用PCR/qPCR) |
Hifair® III 1st Strand cDNA Synthesis Kit(gDNA digester plus) |
||
|
常规30 min反转预混液,含gDNA去除(下游应用qPCR) |
Hifair® II 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus) |
||
|
miRNA反转录试剂盒(加A法) |
Hifair® miRNA 1st Strand cDNA Synthesis Kit (加A法) |
