提升CUT&Tag技能,就不怕卷单细胞ChIP技术了
要问DNA-蛋白质互作技术谁最火?就不得不提CUT&Tag技术了!CUT&Tag技术自2019年问世以来,不断突破创新,从最初只能做组蛋白修饰,到现在越来越多转录因子见刊,甚至各种R-loop、G4结构的研究也被大量报道。更不要说单细胞技术爆火的现在,scCUT&Tag技术中,各种动物、细胞以及植物的文章见刊,并且CUT&Tag技术还衍生出了多靶标CUT&Tag,实现一个细胞,多个靶标的研究。
2021年 大量转录因子研究见刊
2021年1月 scCUT&tag在动物应用方向研究见刊
2022年12月 nano-CUT&Tag推出
更多应用持续更新……
最近经常听到单细胞ChIP技术,小翌立马查阅资料去一探究竟,结果发现还是换汤不换药,这个单细胞ChIP技术不就是咱们scCUT&Tag么?
为了帮助大家提升CUT&Tag实验技能,小翌整理了之前的一些CUT&Tag知识,同时将CUT&Tag实验的甲醛交联方案和CUT&Tag-qPCR方案一起汇总,希望大家进一步提升CUT&Tag技能,后续如果也想尝试单细胞ChIP,或者是已经在做单细胞ChIP,咱们也能更得心应手。
CUT&Tag甲醛交联方案
【注】
A:在CUT&Tag实验开始前,我们需要确定实验方案。随着CUT&Tag技术的发展,科学家们发现有些目标蛋白质在研究时,轻微甲醛交联效果更好。之后,更多的研究表明,使用CUT&Tag技术研究不同蛋白时,所需的实验条件也不一样。做组蛋白修饰、强结合的转录因子(如CTCF、RNA polll等)无需甲醛交联。而一些弱结合的转录因子或转录辅因子则需要甲醛交联,并且甲醛交联的强度也不一样。常规的轻微甲醛交联条件为0.1%甲醛室温交联2 min,之后用0.1 M甘氨酸终止交联。
B:若在实验时,有添加甲醛进行轻微交联,那么后续加终止buffer后,步骤稍微有调整哦!甲醛交联后,蛋白酶K消化步骤调整为:向每个样品中加入2 μL 15× Terminate Solution、1 μL DNA Spike-in mix和1 μL 30× Proteinase K(此时磁珠会板结)(若样品较多,可一起提前配制)。全速涡旋样品约10 sec,混匀后瞬离,将样品置于PCR仪,55 ºC消化2 h (热盖不低于70 ºC)或者37 ºC过夜。
CUT&Tag-qPCR方案
qPCR 定量检测
反应体系(推荐冰上配制)
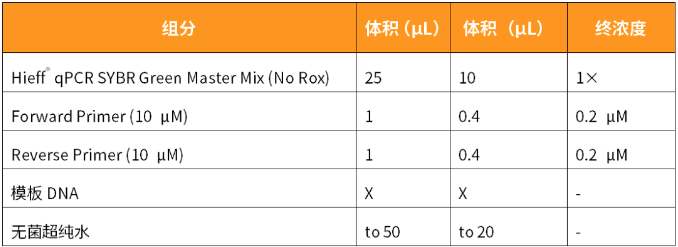
反应程序

【注】
快速程序适用于绝大多数基因,个别复杂二级结构基因可尝试标准程序。
a) 退火温度和时间:请根据引物和目的基因的长度进行调整。
b) 荧光信号采集(★):请按照仪器使用说明书要求进行实验程序设置,几种常见仪器的时间设定如下:
20 sec:Applied Biosystems 7700, 7900HT, 7500 Fast
31 sec:Applied Biosystems 7300
32 sec:Applied Biosystems 7500
c) 熔解曲线:通常情况下可以使用仪器默认程序。
结果分析
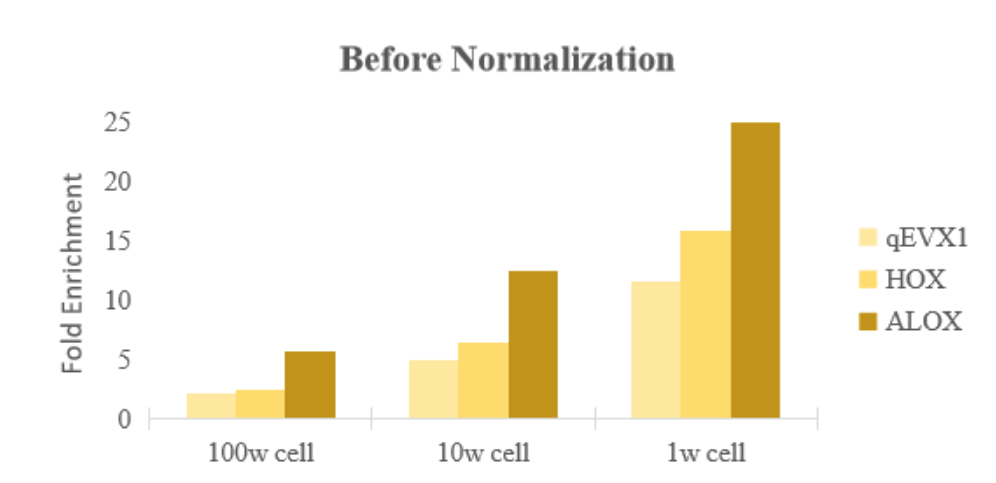
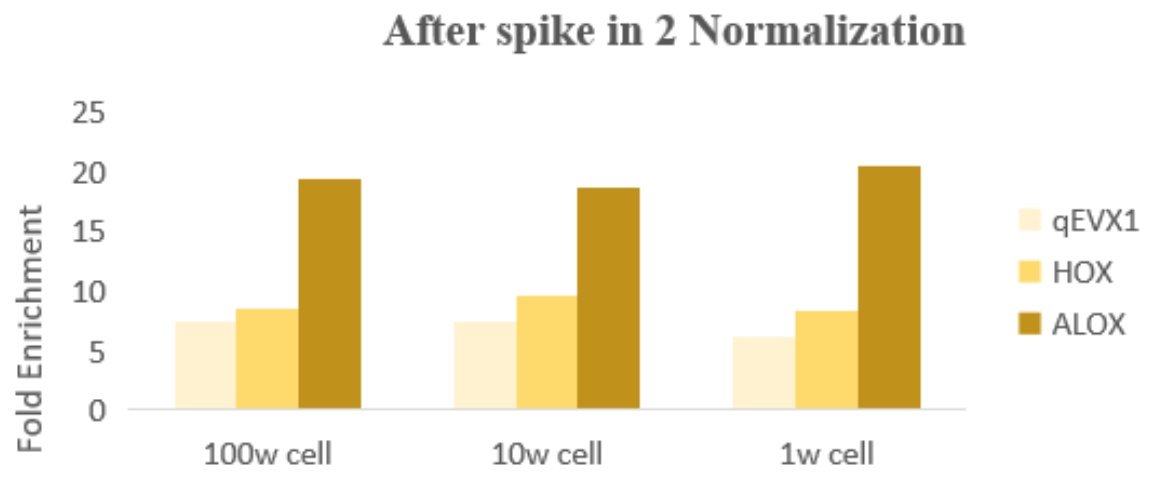
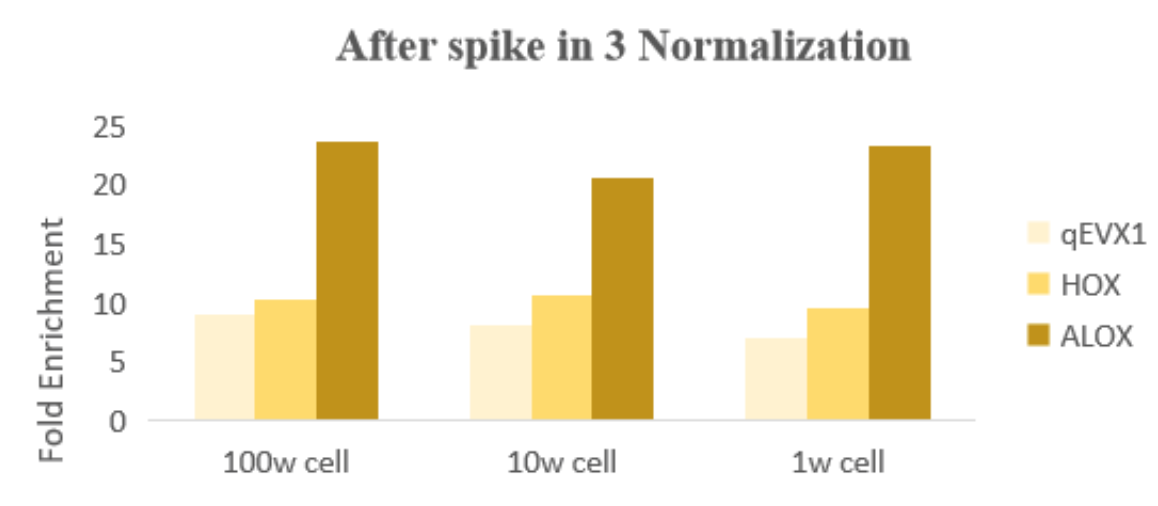
图:使用试剂盒中的spikein 3进行normalization处理,同一基因在不同投入量细胞结果中,基因的富集倍率差异不大。
