ICHQ5A(R2)推荐NGS、NATs用于病毒残留检测
更新点1——
ICHQ5A (R2)推荐NGS用于病毒残留检测
病原NGS检测流程
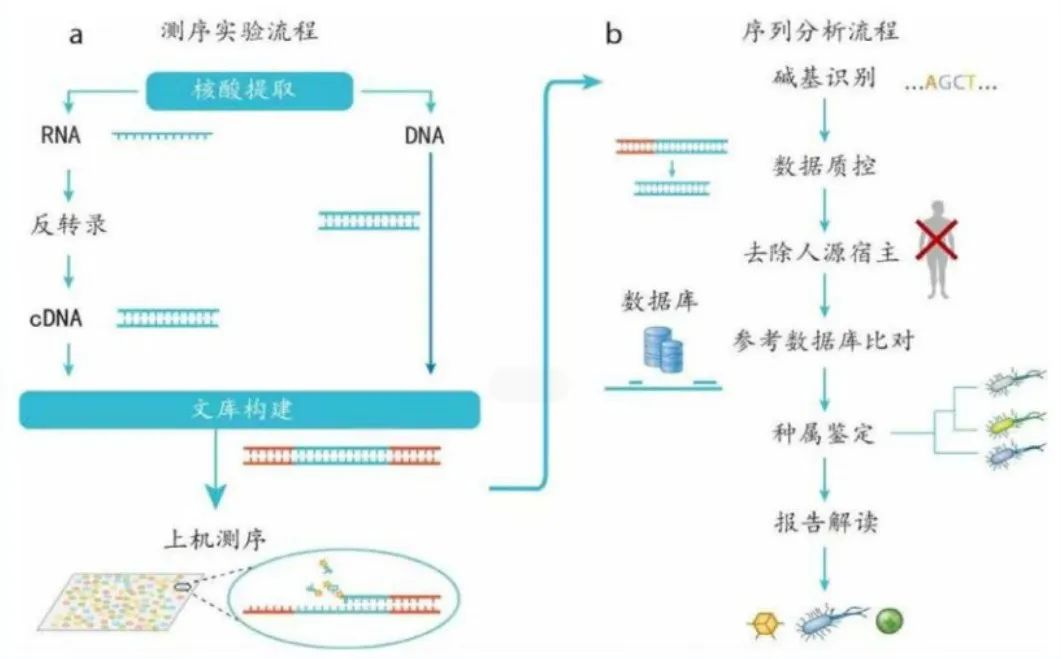
图片来源于文献
NGS在生物制品病毒检测优势
翌圣病原NGS建库解决方案
|
分类 |
产品名称 |
货号 |
规格 |
|
DNA机械法建库 |
Hieff NGS® Ultima DNA Library Prep Kit for Illumina® |
13489ES08/ES24/ES96 |
8 T/24 T/96 T |
|
Hieff NGS® Ultima DNA Library Prep Kit for MGI® |
13508ES08/ES24/ES96 |
8 T/24 T/96 T |
|
|
DNA酶切法建库 |
Hieff NGS® OnePotⅡ DNA Library Prep Kit for Illumina® |
13490ES08/ES24/ES96 |
8 T/24 T/96 T |
|
Hieff NGS® OnePot II DNA Library Prep Kit for MGI® |
13509ES08/ES24/ES96 |
8 T/24 T/96 T |
|
|
DNA转座法建库 |
Hieff NGS® Fast Tagment DNA Library Prep Kit for Illumina® (for 1 ng) |
13468ES08/ES24/ES96 |
8 T/24 T/96 T |
|
RNA/DNA&RNA共建库 |
Hieff NGS® DNA&RNA Library Co-Prep Kit V2 |
12305ES08/ES24/ES96 |
8 T/24 T/96 T |
|
Hieff NGS® Onepot DNA&RNA Library Co-Prep Kit (with rRNA remover) |
13574ES08/ES24/ES96 |
8 T/24 T/96 T |
|
|
多重PCR |
2×Hieff® Multiplex PCR Master Mix |
13606ES08/ES24/ES96 |
8 T/24 T/96 T |
更新点2——
ICHQ5A (R2)新增NATs用于病毒残留检测
翌圣基于NATs病毒检测解决方案
-
SV40 LTA&E1A残留DNA检测试剂盒
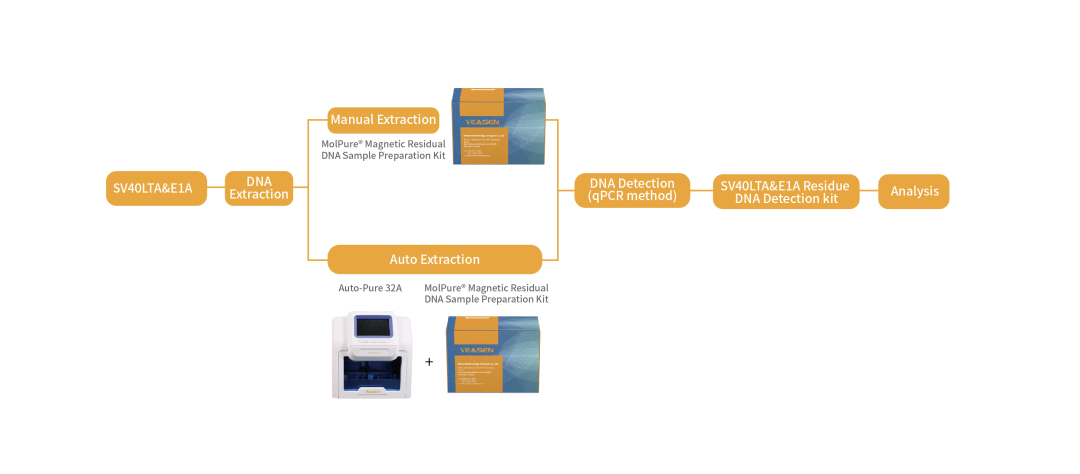
-
复制型慢病毒(RCL)检测试剂盒
翌圣生物自主研发了基于NATs的复制型慢病毒RCL检测试剂盒,采用荧光探针qPCR法特异性扩增慢病毒的包膜蛋白VSV-G基因序列,专一快速的检测各种使用慢病毒载体相关的细胞产品中可能发生的复制型慢病毒的潜在风险。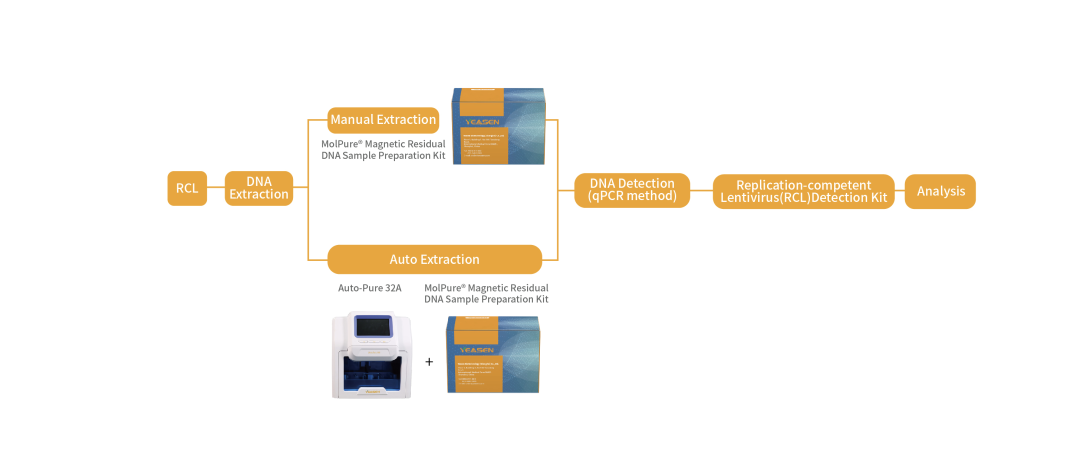
-
MycAway™ Mycoplasma Real-time qPCR Detection Kit 支原体qPCR检测试剂盒(探针法)
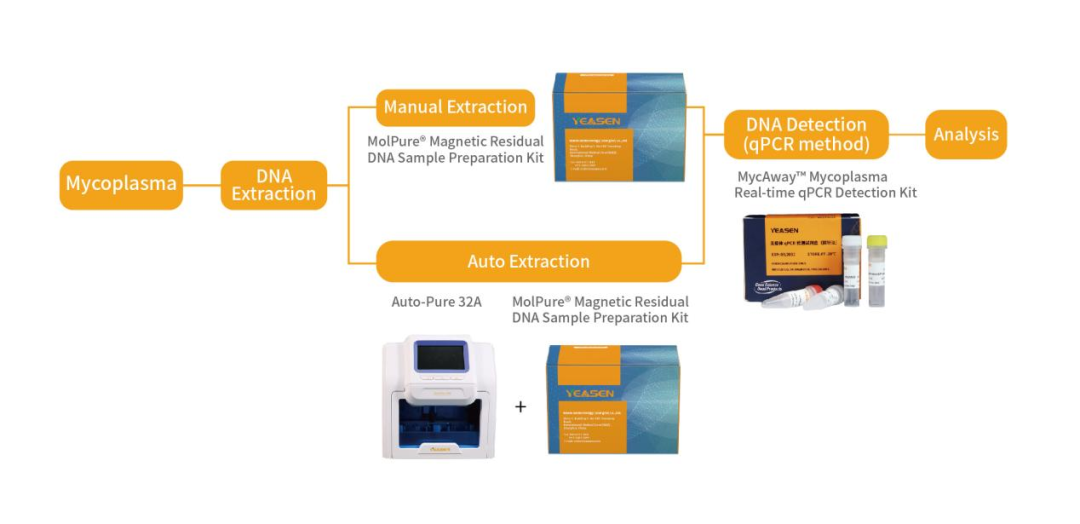
|
产品名称 |
货号 |
规格 |
|
18461ES25/18461ES60 |
25 T/100 T |
|
|
18462ES32/18462ES59 |
2×16 T/6×16T |
|
|
Auto-Pure 32A automated nucleic acid extraction system Auto-Pure 32A全自动核酸提取仪 |
80501ES01 |
32通量 |
|
41310ES50/60 |
50 T/100 T |
|
|
41311ES50/60 |
50 T/100 T |
|
|
40618ES25/40618ES60 |
25 T/100 T |
