mRNA全新转录Buffer&核苷酸助力IVT性能提升
产品信息
|
产品编号 |
产品名称 |
|
10670ES |
|
|
10652ES |
|
|
10653ES |
|
|
10654ES |
|
|
10655ES |
产品优势
1. 提高IVT产量
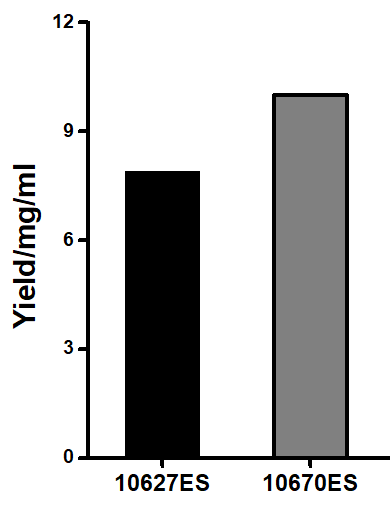
图1. 不同镁离子盐型对IVT产量影响
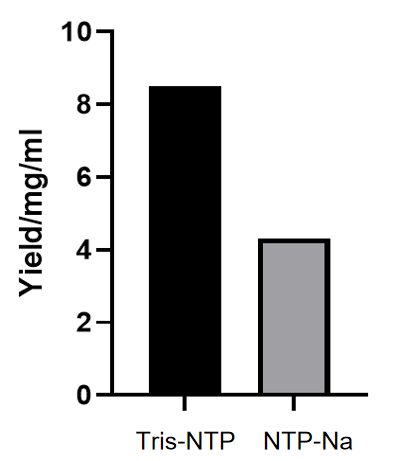
图2.不同NTP盐型对IVT产量影响
-
经优化的TranscriptionBuffer(10670ES)能提升IVT产量 -
经优化的Transcription Buffer(10670ES)搭配Tris-NTP能显著提升IVT产量
2. 抑制dsRNA合成
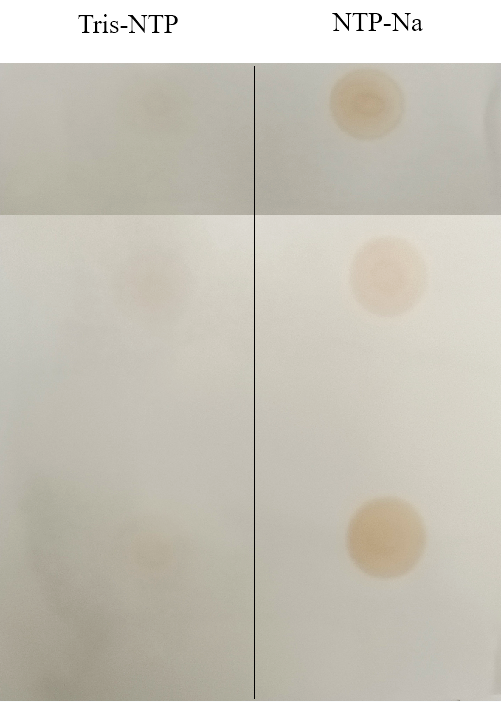
-
Tris-NTP制备的RNA中dsRNA含量明显降低。
产品特色
-
符合ISO 13485体系
-
通过产品稳定性验证
-
符合GMP指南
-
AOF生产过程和原料(TSE & BSE)
-
大规模生产能力
-
产品信息
|
产品编号 |
产品名称 |
包装 |
|
10670ES |
1/10/25/500mL |
|
|
10671ES |
T7 RNA Polymerase Mix GMP-grade |
40/400µL,10/400 mL |
|
10624ES |
5000/50000U |
|
|
10625ES |
10/100/2500KU,100 MU |
|
|
10652ES |
1/5/25/500mL |
|
|
10653ES |
1/5/25/500mL |
|
|
10654ES |
1/5/25/500mL |
|
|
10655ES |
1/5/25/500mL |
|
|
10656ES |
20/100μL,1/5mL |
|
|
10657ES |
20/100μL,1/5/25/500mL |
