翌圣GMP级别IIs型内切酶——mRNA药物疫苗研发生产首选
特殊的IIs型内切酶
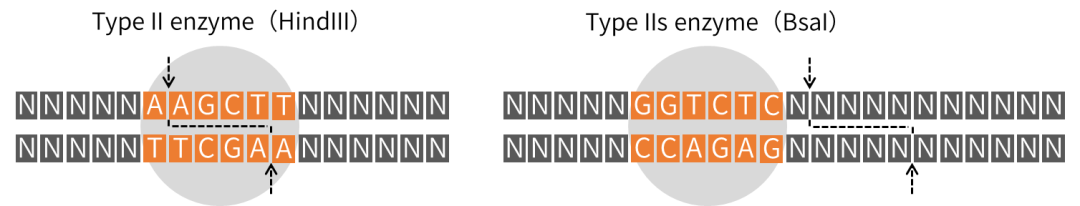
IIs型内切酶基于以上特性,成为了mRNA生产中质粒线性化的首选酶,同时也开创了Golden Gate组装技术。
IIs型内切酶用于质粒线性化
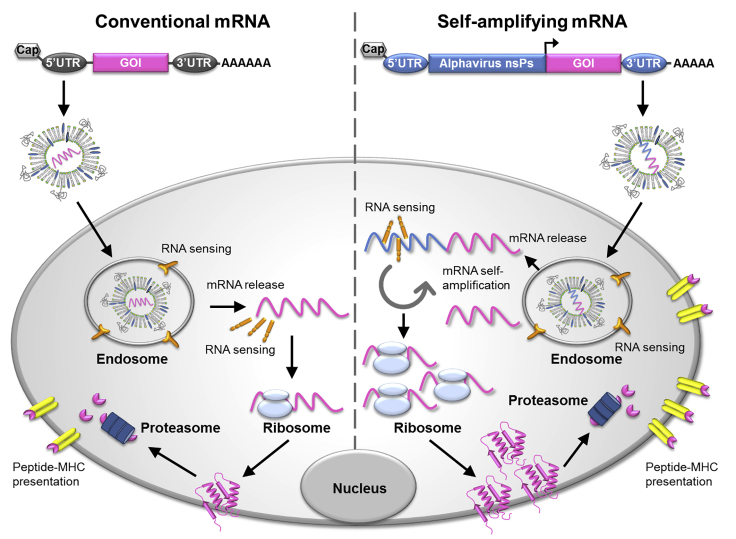
IIs型内切酶的切割位点位于识别位点之外,线性化后的DNA模板上不会留下“疤痕”, 体外转录过程中也不会添加不需要的核苷酸。poly(A)尾巴(具有调节mRNA翻译效率功能)可以通过质粒DNA模板限制切割和转录获得,在mRNA产品中加入特定数目的poly(A)。因此IIs型内切酶成为mRNA体外合成中质粒线性化的首选酶。
IIs型内切酶用于Golden Gate组装
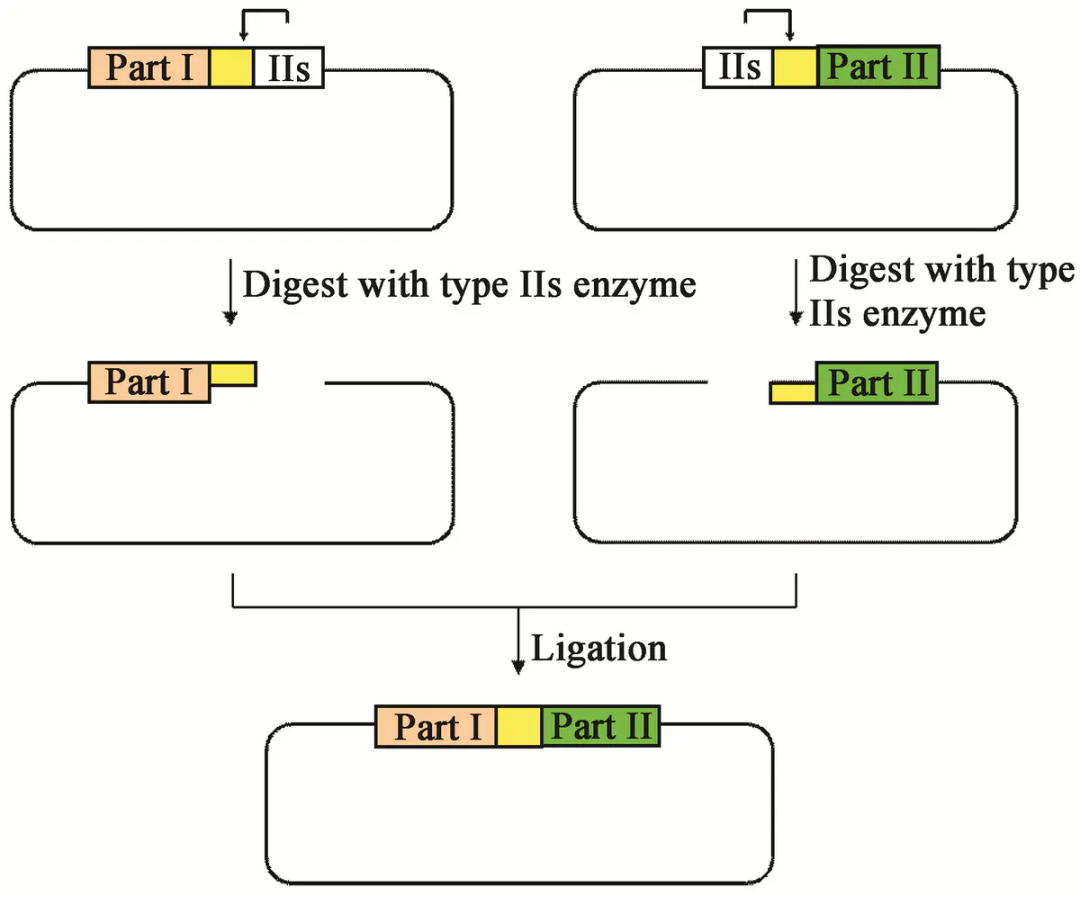
Golden Gate assembly技术流程:
1. 通过PCR扩增或寡核苷酸合成等技术向目的片段中引入IIs型内切酶(如BsaI、BsmBI等)的识别序列。
2. IIs内切酶识别目的片段和载体上的酶切位点,并在识别位点之外进行酶切。
3. 在连接酶的作用下将目的片段和载体进行无缝连接,实现单片段或多片段重组。
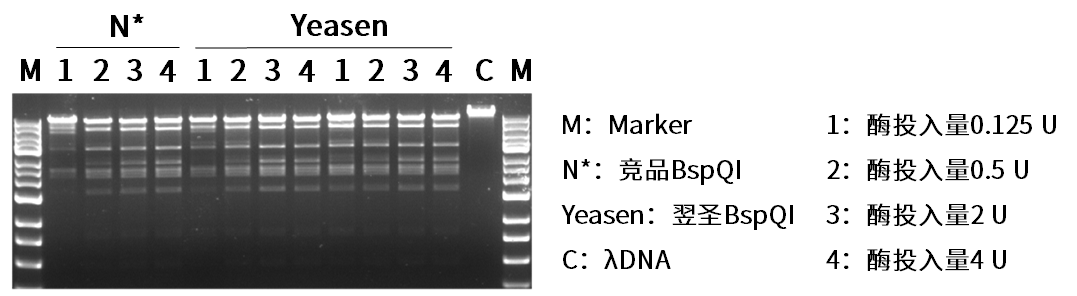
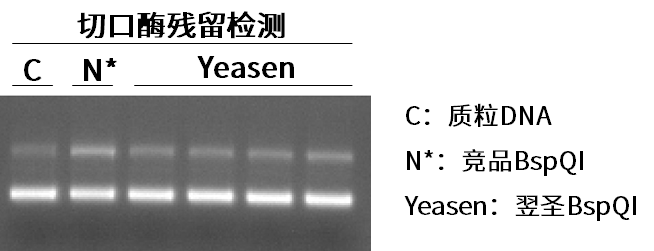
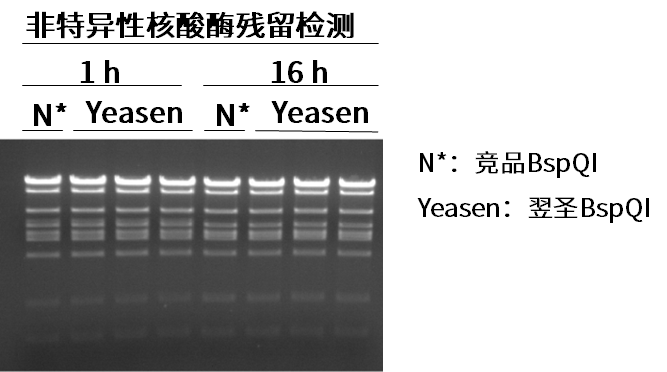
翌圣IIs限制性内切酶-BspQI
产品优势
相关产品推荐
|
产品定位 |
产品名称 |
产品货号 |
|
GMP级别Ⅱs型 |
10664ES |
|
|
常规系列Ⅱs型 |
15202ES |
|
|
15203ES |
||
|
15204ES |
||
|
5-15min快速酶切系列 |
15001ES-15052ES |
