翌圣E.coli DNA ligase,单链DNA建库新利器
什么是E.coli DNA ligase
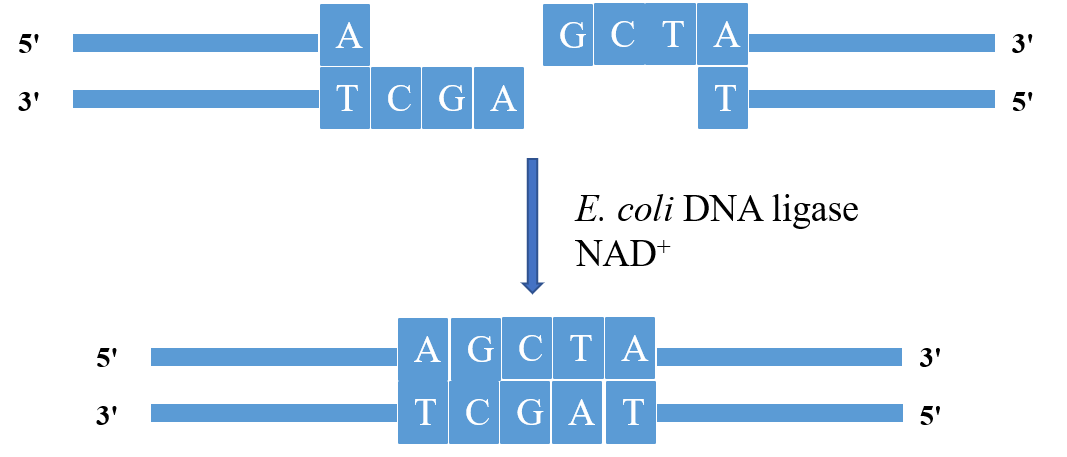
图1. E.coli DNA ligase作用方式
E.coli DNA ligase的应用
一、cDNA文库构建
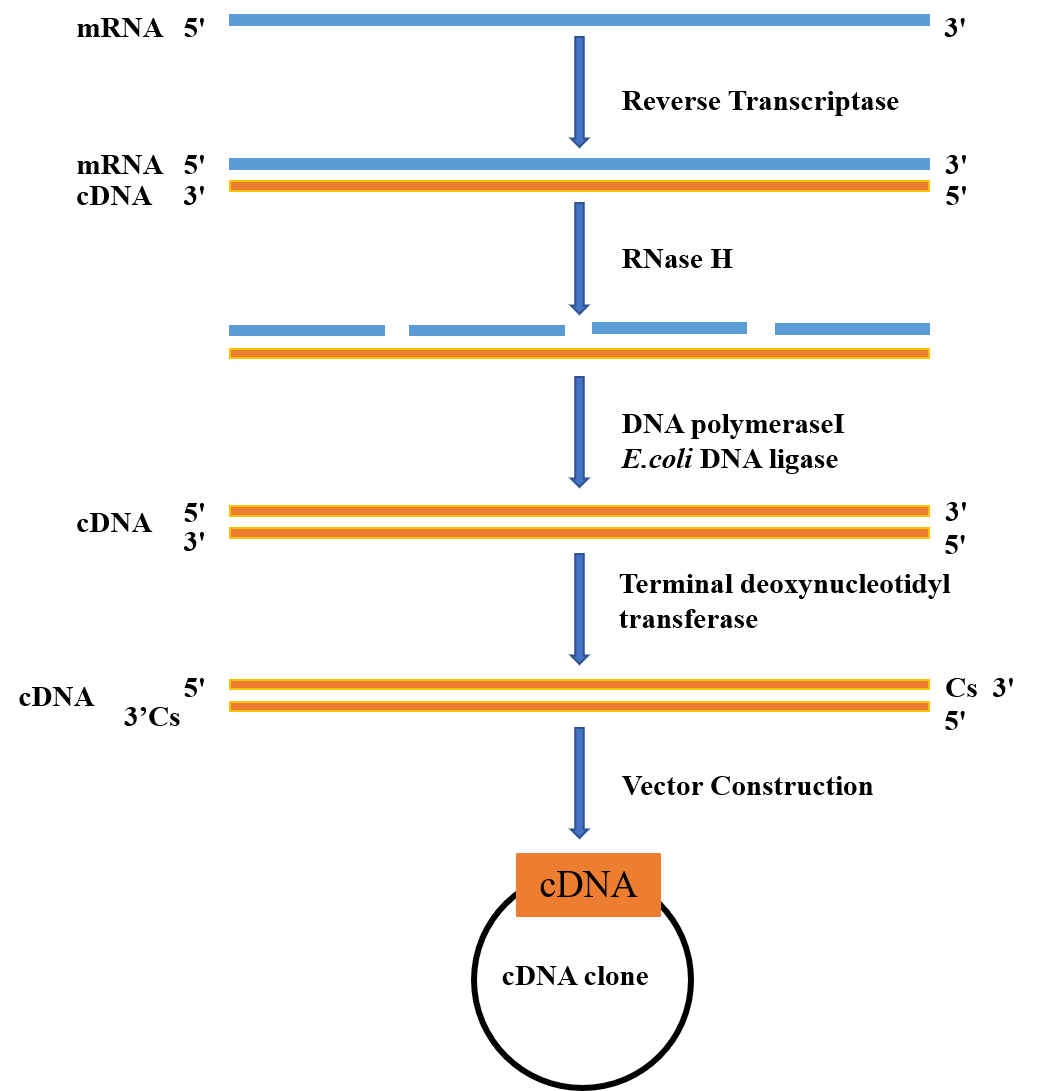
1) 将获取的mRNA使用逆转录酶,反转录为cDNA第一链,生成RNA-DNA杂交复合物;
2) RNase H切割降解RNA-DNA杂合链中RNA;
3) 以cDNA第一链为模板生成cDNA第二链。其中,E.coli DNA ligase可以连接由DNA聚合酶I扩增形成的cDNA片段之间的切口;
4) 使用末端脱氧核苷酸转移酶(Terminal Deoxynucleotidyl Transferase, TDT)在载体以及cDNA片段加上可以互补的同聚物尾巴(如cDNA上的Cs),其中包含20-30个核苷酸序列,用于构建重组载体。
二、NGS单链DNA建库
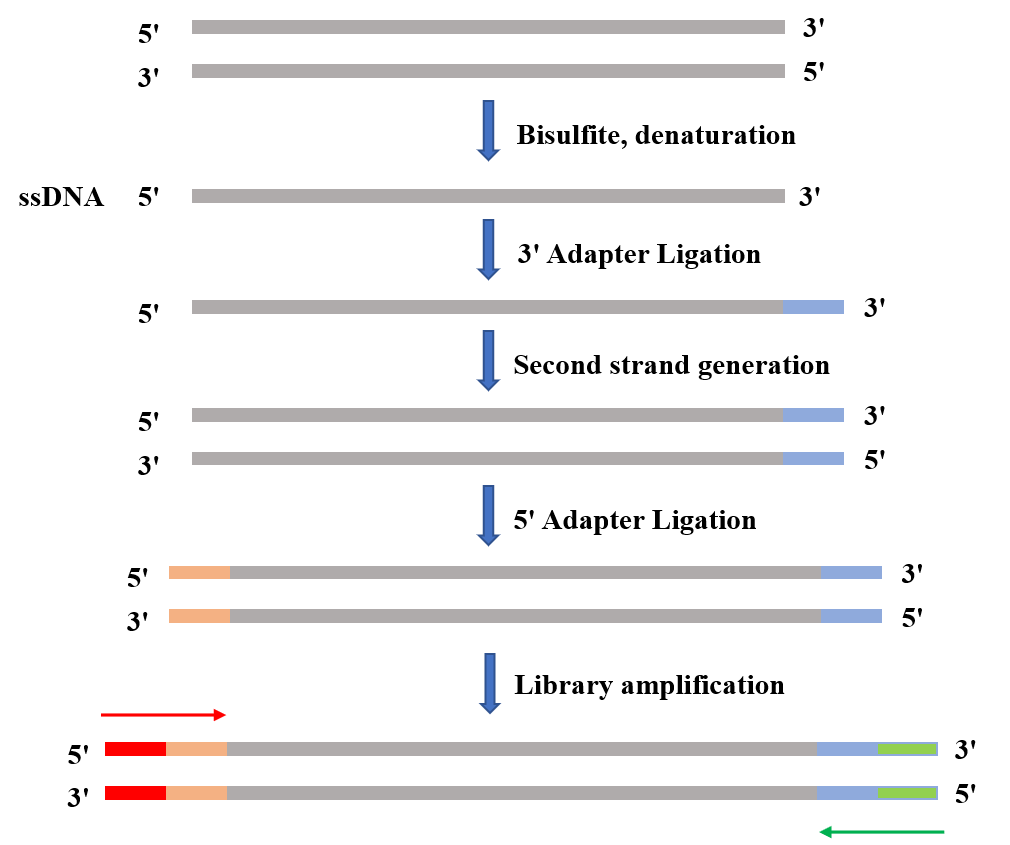
图3. 单链DNA甲基化建库流程
性能展示
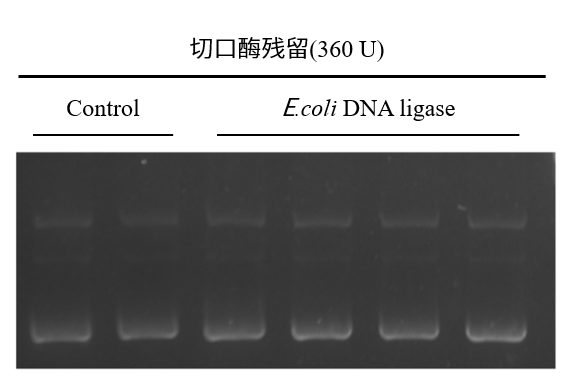
1. 无切口酶残留
2.高纯度
3.客户反馈数据:优异的建库性能
图6中左图为分别使用翌圣两个批次酶Yeasen-1(橙)、Yeasen-2(灰) 和竞品T(蓝)进行10 ng、100 ng 单链DNA起始量建库纯化后文库产量。右图为分别使用翌圣两个批次酶Yeasen-1(橙)、Yeasen-2(灰) 和竞品T(蓝)进行10 ng、100 ng Bisulfite DNA起始量建库纯化后的文库产量。可以看到与竞品T相比,翌圣两批次E.coli DNA ligase在单链DNA建库及Bisulfite DNA建库文库产量更高,表现更优异。
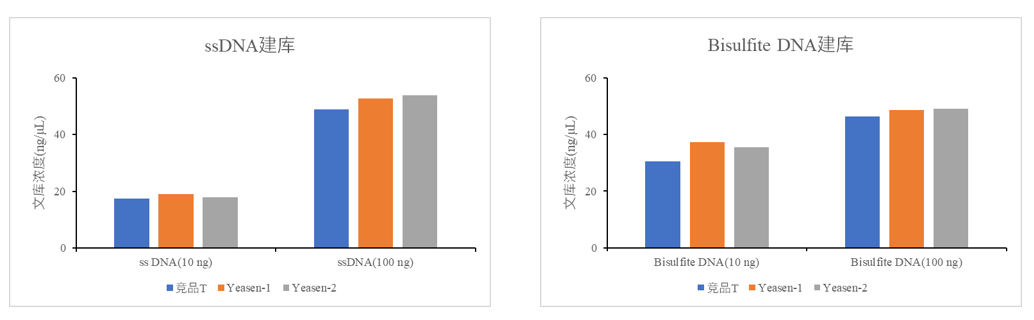
图6. ssDNA、Bisulfite DNA建库数据
产品订购

参考文献
1. Lehman IR. DNA ligase: structure, mechanism, and function. Science. 1974 Nov 29;186(4166):790-7.
2. Okayama H, Berg P. High-efficiency cloning of full-length cDNA. Mol Cell Biol. 1982 Feb;2(2):161-70.
3. Rodríguez-Ezpeleta N, Teijeiro S, Forget L, Burger G, Lang BF. Construction of cDNA libraries: focus on protists and fungi. Methods Mol Biol. 2009; 533:33-47.
4. Vong JSL, Tsang JCH, Jiang P, Lee WS, Leung TY, Chan KCA, Chiu RWK, Lo YMD. Single-Stranded DNA Library Preparation Preferentially Enriches Short Maternal DNA in Maternal Plasma. Clin Chem. 2017 May;63(5):1031-1037.
5. Tabor S. DNA ligases. Curr Protoc Mol Biol. 2001 May;Chapter 3:Unit3.14.
