去糖基化酶助力蛋白和抗体糖型分析
背景介绍
随着糖蛋白质组学和抗体药研究的迅速发展,糖基化修饰也备受关注。糖基化决定了糖复合物的粘附特性,细胞与细胞和细胞与病原体的接触主要是通过糖与蛋白质相互作用完成的。在IgG中,Fc区Asn297处的保守N-连接糖对其活性也至关重要。
去糖基化是将多糖从糖蛋白中去除的过程,从而更好的研究糖蛋白中的多肽部分和多糖部分的结构和功能。
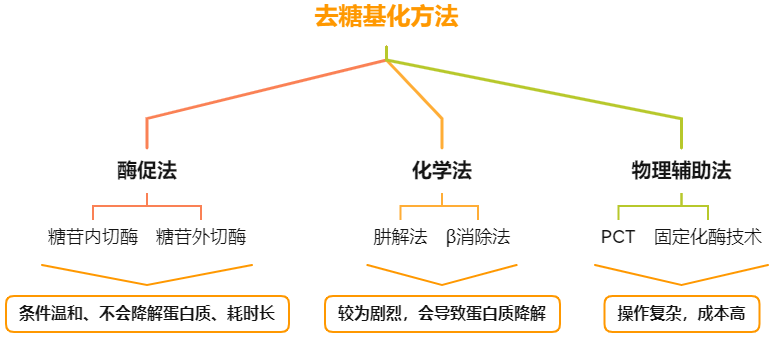
产品简介
PNGase F酶和Endo S均为糖苷内切酶,可以去除糖蛋白或抗体中的N-连接糖。
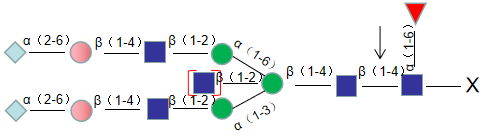
PNGase F酶可以去除几乎所有的N-连接糖,切割的糖型有:高甘露糖型、复合型、杂合型糖链。切割位点为:最内侧N-乙酰葡糖胺(GlcNAc)和天冬酰胺之间,当α1-6岩藻糖位于GlcNAc核心时,PNGase F可以切割;当α1-3岩藻糖位于GlcNAc核心时,PNGase F不能切割。本品为大肠杆菌重组表达。
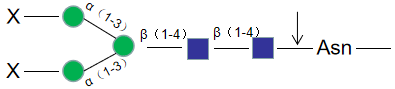
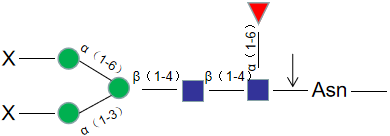
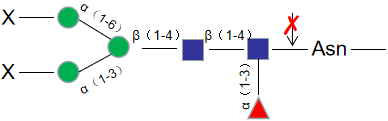
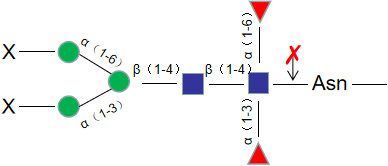
Endo S,中文名是糖苷内切酶S,是一种高度特异性糖苷内切酶,可以从野生型 IgG 重链的壳二糖核心结构之间切除N-连接糖。本产品带有组氨酸(His)标签,易于从反应中去除。
糖苷内切酶S的活性对多肽没有严格的要求,因此X可以 是蛋白质、肽、天门冬酰胺或游离聚糖。无论底物上不没有核心α1-6岩藻糖或平分型N-乙酰葡糖胺,糖苷内切酶S都有活性。但对于具有三、四个支链唾液酸化及去唾液酸化的聚糖,糖苷内切酶S没有活性。
产品应用
|
应用选择 |
PNGase F酶 |
Endo S |
|
从糖蛋白中去除N-连接糖 |
√ |
√ |
|
选择性的从反应中去除酶 |
√ |
|
|
去除N-连接糖中的寡甘露糖(保留与天冬酰胺连接的N-乙酰葡萄糖胺) |
√ |
|
|
从IgG中去除N-连接糖(保留与Asn相连的GlcNAc) |
√ |
|
|
分析治疗性糖蛋白,符合监管机构的要求 |
√ |
|
|
糖组学 |
√ |
√ |
|
蛋白质组学 |
√ |
√ |
|
确定N-连接糖位点 |
√ |
产品特点
产品测试
PNGase F的测试
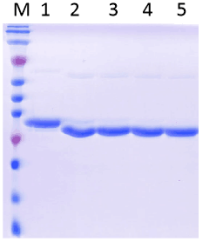
图1 PNGase F酶切结果图
M:Marker;1:对照,未加酶;2-3:PBS,PH 7.4酶切;4-5:TBS,PH 8.0酶切
Endo S的测试
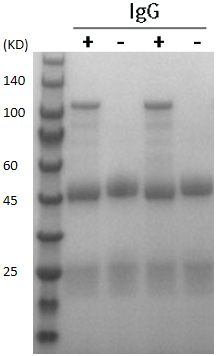
图2 Endo S酶切结果图
产品信息
|
产品名称 |
货号 |
规格 |
价格(元) |
|
20411ES01 |
15000 U |
763 |
|
|
20411ES02 |
75000 U |
3373 |
|
|
20413ES80 |
1000 U |
325 |
|
|
20413ES90 |
5×1000 U |
1365 |
相关产品订购
|
产品名称 |
货号 |
规格 |
价格(元) |
|
20412ES84 |
2000 U |
2233 |
|
|
20412ES90 |
5000 U |
4953 |
引用文献
【1】Elevated transcription and glycosylation of B3GNT5 promotes breast cancer aggressiveness. J Exp Clin Cancer Res. 2022 May 7;41(1):169. doi: 10.1186/s13046-022-02375-5.
【2】Characterization of a novel bispecific antibody targeting tissue factor-positive tumors with T cell engagement. Acta Pharm Sin B. 2022 Apr;12(4):1928-1942. doi: 10.1016/j.apsb.2021.10.028.
【3】Shrimp Plasma CREG Is a Hemocyte Activation Factor. Front Immunol. 2021 Aug 16;12:707770. doi: 10.3389/fimmu.2021.707770.
【4】Secretory expression and purification of recombinant PLA2R epitopes for the detection of anti-PLA2R autoantibody in serum. Analyst. 2022 Feb 28;147(5):965-974. doi: 10.1039/d2an00094f.
