细胞凋亡的形态学变化、原理及常用的检测方法
细胞凋亡(Apoptosis)一词首次出现在Kerr、Wyllie和Currie于1972年发表的一篇经典论文中,用来描述一种形态学上独特的细胞死亡形式。我们对哺乳动物细胞凋亡过程相关机制的了解来自于对秀丽隐杆线虫发育过程中程序性细胞死亡的研究。细胞凋亡被认为是一种独特而重要的“程序性”细胞死亡模式,它是由细胞的基因决定的。细胞凋亡通常发生在发育和衰老过程中,是维持组织内细胞数量的一种稳态机制。如在免疫反应中或当细胞被疾病或有害物质破坏时,细胞凋亡也作为一种防御机制发生。
在细胞凋亡的早期过程中,在光镜下可以看到细胞收缩和固缩。细胞收缩时,细胞体积变小,细胞质致密,细胞器排列更紧密。固缩是染色质凝集的结果,是细胞凋亡最显著的特征。在苏木精和伊红染色组织学检查中,细胞凋亡为单细胞或小簇细胞。凋亡细胞呈圆形或椭圆形肿块,胞质呈深色嗜酸性,核染色质呈致密紫色(图1)。
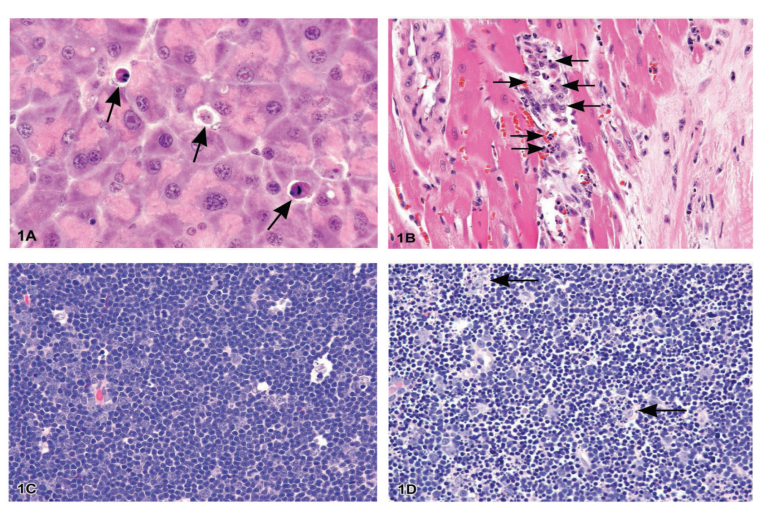
图1所示。图1A是B6C3F1小鼠外分泌胰腺切片的显微照片。箭头表示细胞萎缩,胞浆浓缩的凋亡细胞,核固缩且碎裂。图1B为14周龄大鼠心肌图像,间质内可见凋亡细胞,胞浆浓缩,染色质浓缩深染,细胞核碎片化(长箭头)。图1C是对照大鼠胸腺组织的显微照片。图1D用地塞米松诱导淋巴细胞凋亡的大鼠胸腺中的凋亡细胞图片。在生理条件下,细胞凋亡通常影响单细胞或小簇细胞。凋亡的淋巴细胞小而深嗜碱性,细胞核固缩且常碎裂。巨噬细胞存在,胞浆被吞噬凋亡小巨噬细胞可见吞噬的细胞质凋亡小体(箭头)。 电镜可以更好地确定亚细胞变化。在染色质凝缩期早期,核破裂和细胞碎片分离到凋亡小体,这个过程称为“芽出”(图2A, 2B)。凋亡小体由细胞质组成,细胞器紧密排列,有或没有核片段(图2C)。细胞器仍然保持完整,所有这些都被包裹在一个完整的质膜内。这些小体随后被巨噬细胞、实质细胞或肿瘤细胞吞噬,并在吞噬小体内降解(图2D)。吞噬和消化凋亡细胞的巨噬细胞被称为“可染体巨噬细胞”,经常在淋巴滤泡的反应性生发中心或胸腺皮层中发现。基本上没有与凋亡过程或凋亡细胞清除相关的炎症反应,原因有以下几点:
①凋亡细胞不将其细胞成分释放到周围的间质组织中;
②它们被周围细胞迅速吞噬,从而可能防止继发性坏死;
③吞噬细胞不产生抗炎细胞因子。
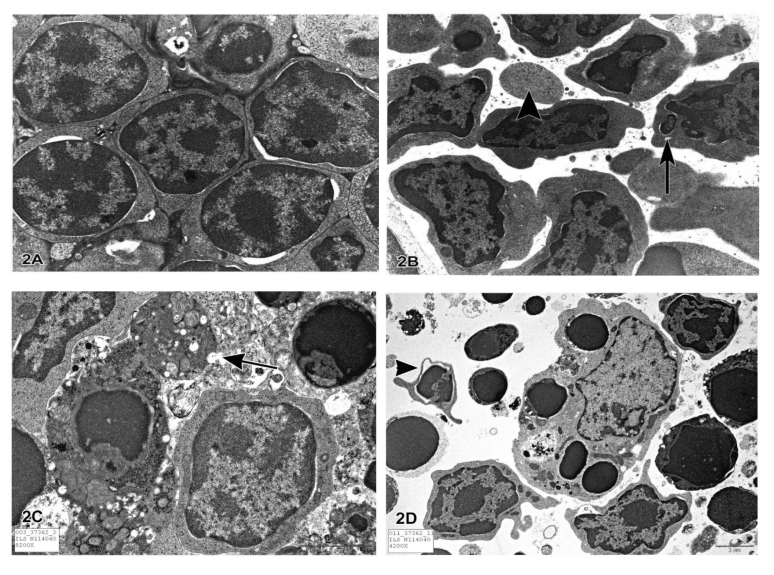
图2A是正常胸腺组织的透射电镜。淋巴细胞排列紧密,细胞核大,细胞质少。图2B是凋亡早期胸腺淋巴细胞的透射电镜图,染色质浓缩,周围化。细胞质开始凝结,细胞轮廓不规则。箭头表示细胞核的碎片。图2C显示了含有细胞器的膜结合细胞质在“萌芽”或挤压过程中的凋亡淋巴细胞(箭头)。一旦萌芽发生,这个挤出的片段将是一个“凋亡体”。这些凋亡小体是膜结合的,因此不会将细胞质内容物释放到间质中。图2D为胸腺切片的不同凋亡阶段的淋巴细胞的电镜图。显微照片中央的大细胞是吞噬细胞质内凋亡小体的巨噬细胞。
细胞凋亡的机制是非常复杂的,涉及到能量依赖的分子级联事件(图3)。迄今为止,研究表明有两种主要的凋亡途径:外部(死亡受体途径)和内部(线粒体途径)。然而,现在有证据表明这两种途径是相互联系的,其中一种途径中的分子可以影响另一种途径。还有一个额外的途径涉及T细胞介导的细胞毒性和穿孔素颗粒酶依赖性的细胞杀伤。穿孔素/颗粒酶通路可以通过颗粒酶B或颗粒酶A诱导细胞凋亡。外源性、内源性和颗粒酶B通路都汇聚在同一个终端或执行通路上。该途径由caspase-3的切割启动,导致DNA碎片、细胞骨架和核蛋白的降解、蛋白的交联、凋亡小体的形成、吞噬细胞受体配体的表达,最后被吞噬细胞摄取。颗粒酶A途径通过单链DNA损伤激活平行的caspase独立细胞死亡途径。
生化特征:凋亡细胞表现出几种生化修饰,如蛋白质切割、蛋白质交联、DNA分解和吞噬识别,这些共同导致了前面描述的独特的结构病理。在大多数细胞中,Caspases(半胱天冬酶)以一种不活跃的原酶形式广泛表达,一旦被激活,通常可以激活其他的半胱天冬酶,允许蛋白酶级联的启动。一些caspase前体也可以聚合和自动激活。这种蛋白水解级联,其中一个caspase可以激活其他caspase,放大了凋亡信号通路,从而导致快速细胞死亡。尽管不同的半胱天冬酶对邻近氨基酸的识别具有不同的特异性,但它具有蛋白水解活性,能够裂解天冬氨酸残基上的蛋白质。一旦caspase最初被激活,细胞死亡似乎是不可逆转的。
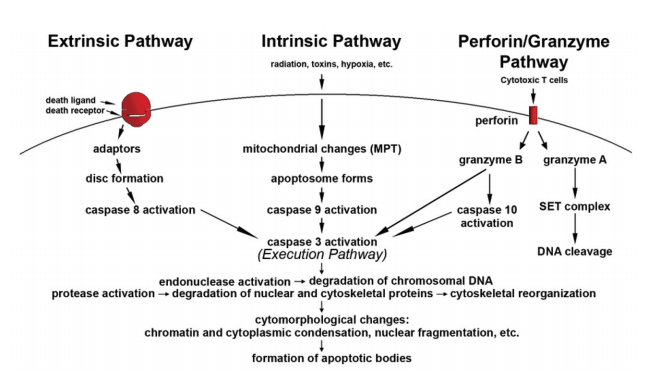
图3。凋亡事件示意图。细胞凋亡的两种主要途径是内源性和外源性以及穿孔素/颗粒酶途径。每一种都需要特定的触发信号来启动依赖能量的分子级联事件。每个通路都激活自己的启动子caspase(8,9,10),进而激活caspase-3。然而,颗粒酶A以caspase独立的方式工作。执行途径导致典型的细胞形态学特征,包括细胞收缩、染色质凝结、细胞质泡和凋亡小体的形成,最后凋亡小体被邻近的实质细胞、肿瘤细胞或巨噬细胞吞噬。
形态学检测
如图1,2所展示,可以进行染色后在光学显微镜下观察,也可以电镜下观察凋亡的形态学变化。
DNA片段化相关检测
DNA技术被用来可视化凋亡的内切酶裂解产物。该方法包括从溶解的细胞匀浆中提取DNA,然后进行琼脂糖凝胶电泳。这就形成了一个有特色的“DNA阶梯”,阶梯中的每个条带在大小上被大约180个碱基对隔开。该方法操作简单,适用于每组织质量或体积中凋亡细胞数量较高的组织和细胞培养物。另一方面,不建议在凋亡细胞数量较少的情况下使用。这种试验还有其他缺点。由于DNA碎裂发生在细胞凋亡的后期,DNA阶梯的缺失并不能消除细胞发生早期凋亡的可能性。此外,在制备过程中可能会发生DNA碎片,使核小体梯难以产生,坏死细胞也会产生DNA碎片。
TUNEL (Terminal dUTP Nick End-Labeling)方法被用于通过酶标记DNA链断裂的末端来测定内切酶裂解产物。末端转移酶用于将标记的UTP添加到DNA片段的3'端。然后可以用各种探针对dUTP进行标记,以便用光学显微镜、荧光显微镜或流式细胞术进行检测。TUNEL检测法可以通过荧光显微镜检测单个细胞,也可以通过流式细胞术检测约100个细胞。这也是一种快速的技术,可以在3小时内完成。
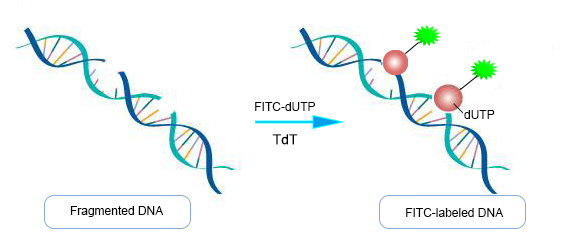
图4:Tunel检测法示意图
膜的改变的相关检测
膜的改变凋亡细胞外质膜上磷脂酰丝氨酸残基的外化使得通过组织、胚胎或培养细胞中的Annexin V进行检测。一旦凋亡细胞与FITC标记的Annexin V结合,就可以用荧光显微镜观察到它们。其优点是灵敏度高,可以检测单个凋亡细胞,缺点是坏死细胞的细胞膜也会被标记出来。因此,关键点是显示磷脂酰丝氨酸阳性细胞的膜完整性。由于细胞膜完整性的丧失是坏死细胞的一个病理特征,因此坏死细胞会被特定的膜非渗透核酸染料染色,如碘化丙啶和台盼蓝。随着细胞的染料积累和体积缩小,细胞的染料含量变得更集中,可以用光学显微镜观察。这种染料吸收生物测定法适用于细胞培养,不标记坏死细胞,具有高水平的灵敏度(可以检测单个凋亡细胞)。
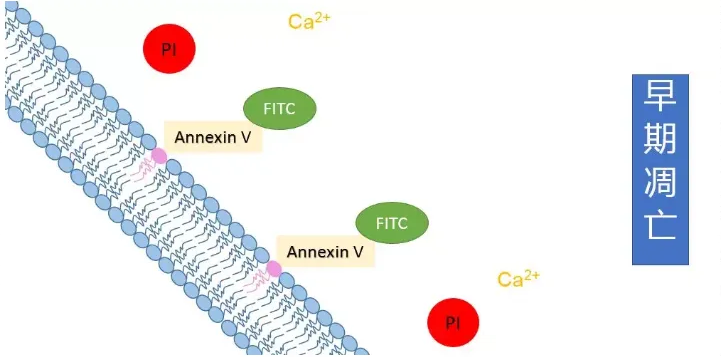
图5:Annexin V /PI双染色法检测的原理
以上总结的是常用的细胞凋亡检测方法,细胞凋亡就是凋亡通路中的各种分子促成的,不能因为检测单一指标就轻易断定凋亡的发生。毕竟,细胞凋亡事件中,每个指证只维持一段时间,因而各位小伙伴们最好能在不同时间段进行多指标的同时检测,这才能确定凋亡的发生。最后为了不造成假阳性和假阴性,阳性和阴性对照也是必不可少的,以保证检测结果的准确性。 为回馈大家对翌圣生物细胞凋亡检测试剂的支持,正在进行包括凋亡检测试剂在内的细胞类产品的促销活动,请直接与当地销售联系获取最新促销信息。
|
产品名称 |
货号 |
规格 |
|
40302ES20/50/60 |
20T/50T/100T |
|
|
40303ES20/50/6 |
20T/50T/100T |
|
|
40304ES20/50/6 |
20T/50T/100T |
|
|
40305ES20/50/6 |
20T/50T/100T |
|
|
40306ES20/50/6 |
20T/50T/100T |
|
|
40307ES20/50/6 |
20T/50T/100T |
|
|
40308ES20/50/6 |
20T/50T/100T |
|
|
40310ES20/50/6 |
20T/50T/100T |
|
|
40706ES60 |
100T |
|
|
40752ES60 |
100T |
