活体成像生物发光技术——直观灵敏的体内追踪成像技术
活体成像技术是指应用影像学方法,在不损伤动物的前提下,对活体状态下的生物过程进行组织、细胞和分子水平的定性和定量研究的技术。通过这项技术可以非侵入式、直观地观测活体动物体内肿瘤的生长,转移、疾病的发展过程、基因的表达变化等生物学过程。与传统剥瘤称重测量的方法相比,活体成像能够对同一种实验对象在不同时间点进行观察,跟踪同一观察目标(标记细胞及基因),数据更加真实可信,成本更低,灵敏度更高。目前活体成像技术主要采用生物发光(Bioluminescence)与荧光(Fluorescence)两种技术,生物发光技术是用荧光素酶(Luciferase)基因标记细胞或者DNA,而荧光技术则是应用荧光蛋白(如GFP, Mcherry等)标记细胞或是蛋白等研究对象。其中生物发光技术因其操作简单,反应灵敏,在肿瘤,分子互作及信号传导等研究中得到了广泛应用。
技术原理
活体成像生物发光技术是指在小的哺乳动物体内利用报告基因(如荧光素酶基因)表达产生的荧光素酶蛋白与其小分子底物荧光素在氧、Mg2+存在的条件下消耗ATP发生氧化反应,将部分化学能转化为可见光能释放,然后在体外利用敏感的CCD设备形成图像。发光强度与标记细胞的数目呈线性相关。荧光素酶报告基因质粒可以被插入多种基因的启动子,成为某种基因的报告基因,通过检测报告基因从而实现对目标基因的监测。
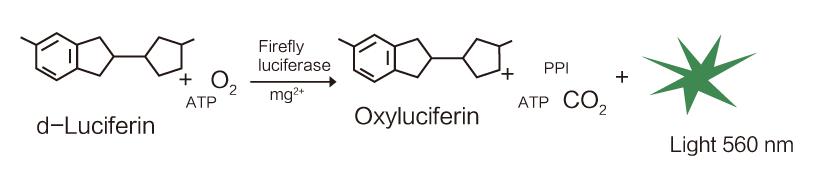
图1:荧光素酶催化荧光素发光反应
生物发光其本质为化学发光,荧光素被荧光素酶氧化的过程中可以释放波长广泛的可见光,波长范围为460-630nm(平均波长为560nm)。在哺乳动物体内,血红蛋白是吸收可见光的主要成分,能吸收蓝绿光波段中的大部分可见光;水和脂质主要吸收红外线,但其均对波长为590-800nm的红光近红外线吸收能力较差,因此波长超过600nm的红光虽然有部分散射消耗但大部分可以穿透哺乳组织被高灵敏的CCD检测到。
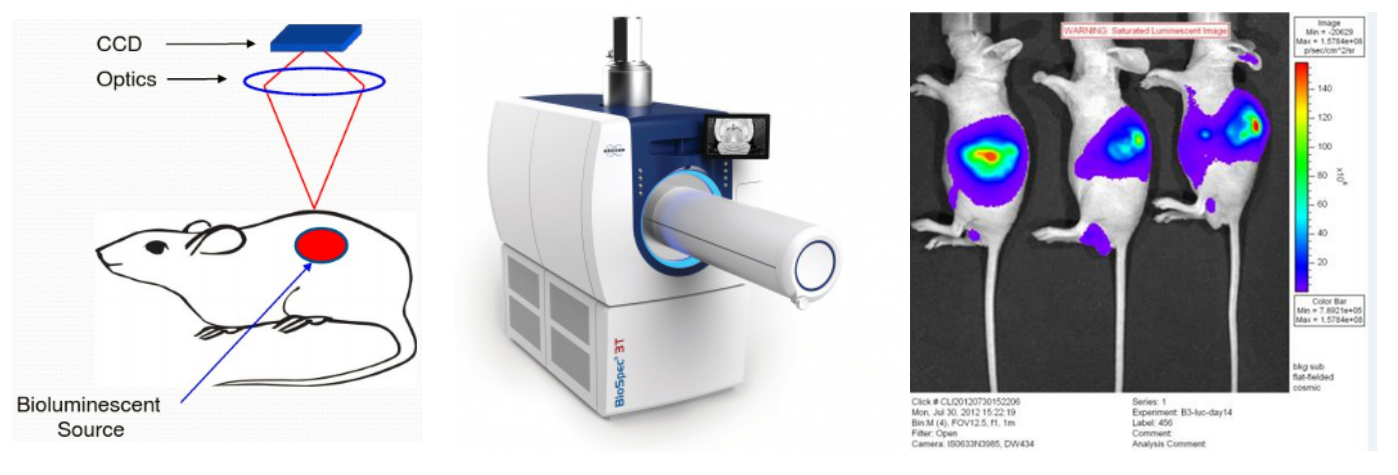
图2:活体成像检测原理,仪器及实验效果图
产品简介
翌圣为科研工作者提供三种形式的荧光素底物
|
D-Luciferin, Sodium Salt(荧光素钠盐) |
D-Luciferin, Potassium Salt(荧光素钾盐) |
D-Luciferin Firefly, Free Acid(荧光素游离酸) |
|
|
分子式 |
NaC11H7N2O3S2·H2O |
C11H7N2O3S2 K |
C11H8N2O3S2 |
|
分子量 |
320.32 |
318.42 |
280.33 |
|
外观 |
淡黄色粉末 |
淡黄色粉末 |
类白色至浅黄色粉末 |
|
溶解性 |
易溶于水(100 mg/ml) |
易溶于水(60 mg/ml) |
难溶于水,可加入稀碱促进其溶解。 |
产品应用
活体成像技术应用范围主要包括:癌症与抗癌药物研究、免疫学与干细胞的研究、细胞凋亡、病理机制及病毒研究、基因表达和蛋白质之间相互作用、转基因动物模型构建、药效评估、药物甄选与预临床检验、药物配方与剂量管理、肿瘤学应用、生物光子学检测、视频监督与环境监督等。
1.肿瘤学
活体成像技术可以在近无创条件下对活体组织或小动物体内的生物学行为进行成像跟踪,已被广泛应用于肿瘤研究中。
活体生物发光成像技术能够让研究人员直接快速的测量各种癌症模型中肿瘤的生长、转移以及对药物的反应。其特点是极高的灵敏度使微小的肿瘤病灶(少到几百个细胞)也可以被检测的到。比传统方法的检测灵敏度大大提高,非常适合于肿瘤体内生长的定量分析。避免屠杀老鼠而造成的组间差异,节省动物成本。由于以上特点,使基于转移模型、原位模型、自发肿瘤模型等方面的肿瘤学研究得到发展。建立肿瘤转移模型,可以观察肿瘤转移情况,进一步探讨肿瘤转移的机制。
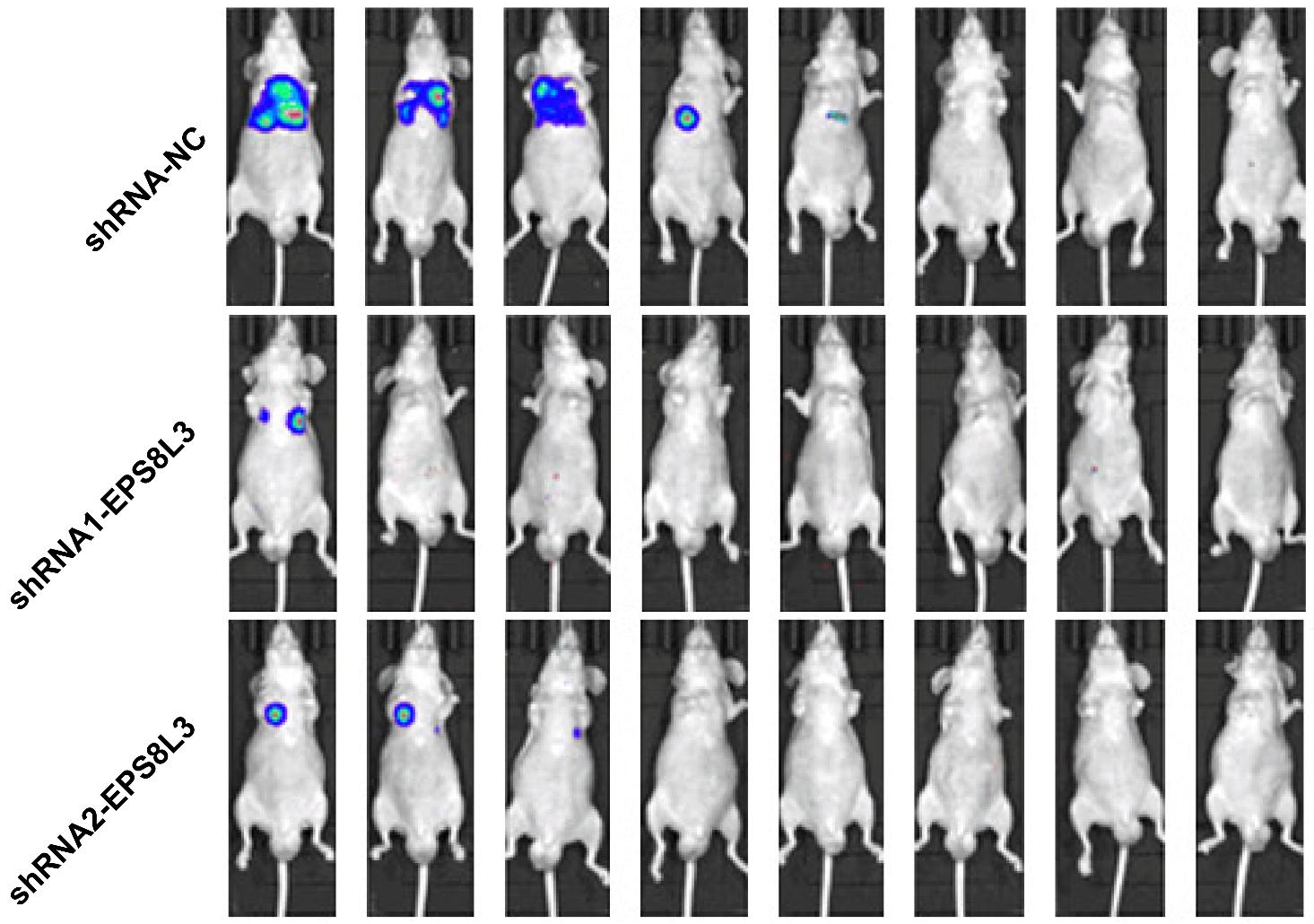
图3: 活体成像检测EPS8L3对小鼠肺部HCCLM3细胞成瘤的影响[1]
2.药物研究
(1)抗肿瘤药物研究
由于活体成像技术具有更高的灵敏度,比传统方法能够更精准地对早期瘤块细胞进行检测。同时,该技术检测到的细胞仅为活细胞。因此,该技术能够更早更灵敏地发现药物的疗效。
通过给予肿瘤接种的小鼠不同剂量、不同给药时间、不同给药途径,观察并制定合适的剂型与服药时间。
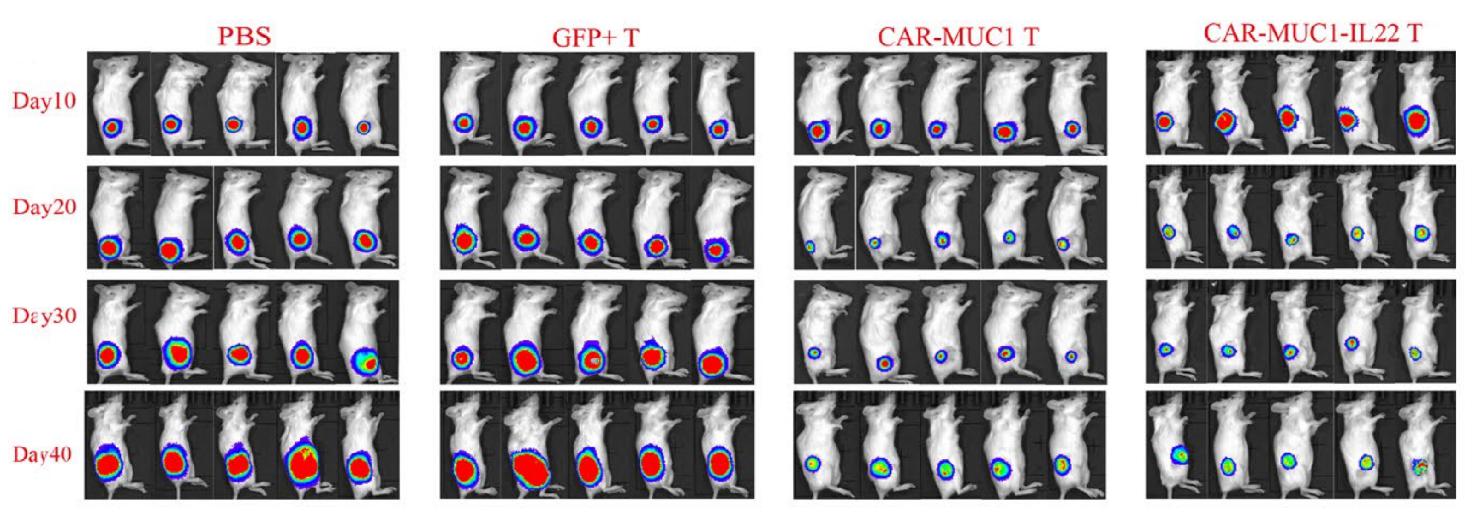
图4:活体成像检测CAR-MUC1 T/CAR-MUC1-IL22 T细胞对小鼠皮下注射HN4细胞成瘤的治疗作用[2]
(2)药物代谢相关研究:
标记与药物代谢有关的基因,研究不同药物对该基因表达的影响,从而间接获知相关药物在体内代谢的情况。在药剂学研究方面,可通过把荧光素酶报告基因质粒直接装在载体中,观察药物载体的靶向脏器与体内分布规律。在药理学方面,可用荧光素酶基因标记目的基因,观察药物作用的通路。
(3)细胞标记
免疫细胞研究:标记免疫细胞,观察免疫细胞对肿瘤细胞的识别和杀死功能,评价免疫细胞的免疫特异性、增殖、迁移等功能。
干细胞研究:A:标记组成性表达的基因,在转基因动物水平,标记干细胞,若将干细胞移植到另外动物体内,可用活体生物发光成像技术示踪干细胞在体内的增殖、分化及迁移的过程。B:用慢病毒直接标记细胞后,移植到体内观测其增殖、分化及迁移过程,研究其修复、治疗损伤或缺陷部分的效果,进一步探讨其机制。
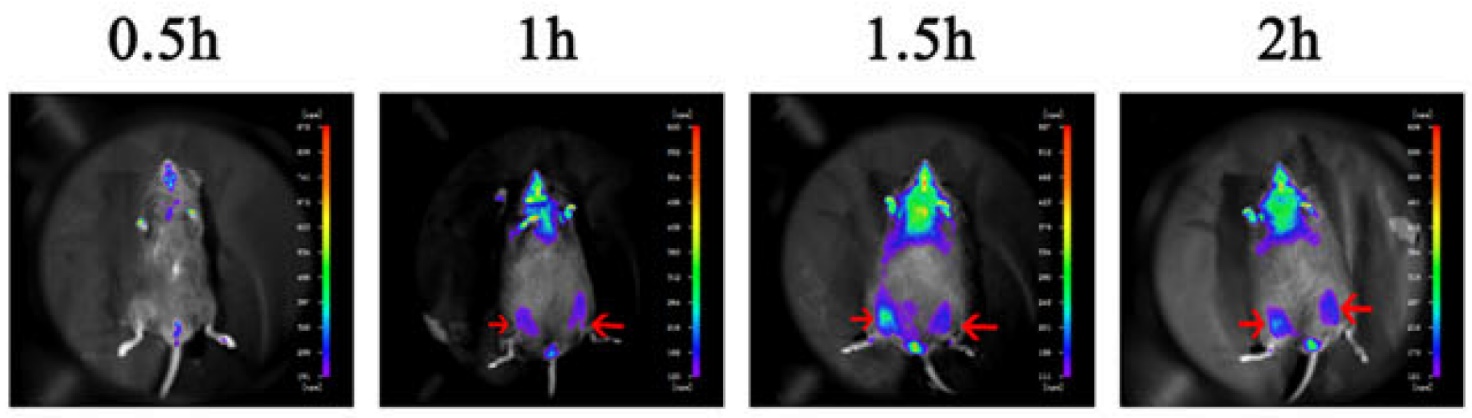
图5:小鼠骨骼肌注射HUC-MSCs细胞后利用活体成像检测细胞的定位[3]
(4)基因表达与基因功能的研究
将荧光素酶基因插入到目的基因启动子的下游,并稳定整合于实验动物染色体中,形成转基因动物模型。该方式可实现目的基因与荧光素酶的表达平行,从而可直接观察目的基因的表达模式,包括数量、时间、部位及影响其表达和功能的因素。
(5)细胞凋亡
用分子生物学方法在荧光酶的两端连接上抑制发光的蛋白(如激素酶),但在其连接处加上caspase,细胞发生凋亡时,表达caspase,切开抑制荧光酶发光的蛋白,使荧光素酶开始发光。
应用前景
活体成像技术能够将分子生物学技术从体外研究转移到动物体内研究。因此,该技术能够观测活体动物内的基因表达和细胞活动,并且该技术具有检测灵敏度高,操作简单等优势,正在越来越广泛地应用于医学及生物学研究领域。
客户已发表文章
1. Chen G, Fan XY, Zheng XP, Jin YL, Liu Y, Liu SC. Human umbilical cord-derived mesenchymal stem cells ameliorate insulin resistance via PTEN-mediated crosstalk between the PI3K/Akt and Erk/MAPKs signaling pathways in the skeletal muscles of db/db mice. Stem Cell Res Ther. 2020 Sep 16;11(1):401. doi: 10.1186/s13287-020-01865-7. PMID: 32938466; PMCID: PMC7493876.
2. Tang Y, Lin S, Yin S, Jiang F, Zhou M, Yang G, Sun N, Zhang W, Jiang X. In situ gas foaming based on magnesium particle degradation: A novel approach to fabricate injectable macroporous hydrogels. Biomaterials. 2020 Feb;232:119727. doi: 10.1016/j.biomaterials.2019.119727. Epub 2019 Dec 24. PMID: 31918223.
3. Xuan Z, Zhao L, Li Z, Song W, Chen J, Chen J, Chen H, Song G, Jin C, Zhou M, Xie H, Zheng S, Song P. EPS8L3 promotes hepatocellular carcinoma proliferation and metastasis by modulating EGFR dimerization and internalization. Am J Cancer Res. 2020 Jan 1;10(1):60-77. PMID: 32064153; PMCID: PMC7017737.
4. Zhou Y , Zhou C , Zou Y , Jin Y , Han S , Liu Q , Hu X , Wang L , Ma Y , Liu Y . Multi pH-sensitive polymer-drug conjugate mixed micelles for efficient co-delivery of doxorubicin and curcumin to synergistically suppress tumor metastasis. Biomater Sci. 2020 Sep 21;8(18):5029-5046. doi: 10.1039/d0bm00840k. Epub 2020 Aug 19. PMID: 32812957.
5. Qiu J , Peng P , Xin M , Wen Z , Chen Z , Lin S , Kuang M , Fu Y , Fang G , Li S , Li C , Mao J , Qin L , Ding Y . ZBTB20-mediated titanium particle-induced peri-implant osteolysis by promoting macrophage inflammatory responses. Biomater Sci. 2020 Jun 7;8(11):3147-3163. doi: 10.1039/d0bm00147c. Epub 2020 May 4. PMID: 32363359.
FAQ
Q1:生物发光与荧光技术的比较
|
生物发光 |
荧光 |
|
|
优点 |
(1)高度灵敏 (2)成像速度快,图像清楚 (3)在体内可检测到102个细胞 |
(1)有多种蛋白和染料可用 (2)可进行多重标记,标记相对简单 (3)可同时用于FACS分类 |
|
缺点 |
(1)信号较弱,需要灵敏的CCD镜头 (2)对仪器的精密度要求较高 (3)目标细胞或者基因需要标记 |
(1)非特异性荧光对其灵敏度产生限制 (2)体内检测最低约106细胞 (3)需要不同波长的激发光 (4)很难精确体内定量 |
Q2:如何能检测到体内发出的可见光?
A:两个主要的原因能够保证可见光成像技术能够检测到体内发出的微弱的可见光。a:高灵敏度的制冷CCD镜头,可达到零下-105℃,体内发出的非常少的光子也能检测得到。b:绝对密封的暗箱装置,可以屏蔽包括射线在内的所有光线。
Q3:大鼠可否用作活体成像实验?
A:成体老鼠和裸鼠,幼鼠及胚胎的区别只在于对可见光的穿透性不同,可见光的穿透能力在3-4cm之间,所以大鼠也可以作为活体成像的动物,关于大鼠活体成像已有很多文章发表。
Q4:CCD镜头的低温会不会对小动物产生影响?
A:不会的,低温的范围只局限于CCD镜头的小范围内,其他范围内都是室温。
Q5:用荧光素进行活体成像与绿色荧光蛋白检测体内发光相比优势何在?
A:荧光素酶的偏红光比绿色荧光蛋白的绿光在体内的穿透性要强近100倍。荧光素是靠和荧光素酶的相互作用发光,特异性很强,得到的信噪比较高;荧光蛋白需要激发光来产生反射光,但是在检测的过程中,老鼠的皮毛,皮肤都会产生非特异性荧光,使得信噪比降低。荧光蛋白检测更适合于体外检测,荧光素酶的检测更适合于体内检测。
Q6:与传统技术相比,生物发光成像技术优势体现在哪些方面?
A:与传统技术相比,该技术对于肿瘤转移的研究、基因治疗、流行病学的发病学研究,干细胞示踪,白血病的相关研究等方面,用该技术进行肿瘤的药效研究,比传统方法更灵敏,还可以通过一系列转基因动物疾病模型,来快速直观的进行相关疾病的发病机理和药物筛选研究。
Q7:如何用荧光素酶基因标记干细胞吗?
A:可标记组成性表达的基因,做成转基因小鼠,干细胞就被标记了,从该小鼠的骨髓取出造血干细胞,移植到另外一只小鼠的骨髓内,可以用该技术示踪造血干细胞在体内的增殖和分化及迁徙到全身的过程。另外一种方法是用慢病毒标记神经干细胞。
Q8:在注射荧光素后多久进行检测比较合适,发光能持续多久?
A:腹腔注射一般10-15min后荧光信号达到最强的稳定期,20-30min后开始衰减,3h后荧光素排除,发光完全消失。
Q9:怎么将荧光素注入小鼠体内,注射方法之间的区别是什么?
A:荧光素可通过腹腔注射或尾部静脉注射注入小鼠体内。约1 min可扩散到小鼠全身。大部分情况下使用荧光素浓度为150 mg/kg。对于20 g的小鼠约使用3 mg的荧光素即可。对于腹腔注射来讲,扩散较慢,开始发光较慢,持续发光时间较长。对于荧光素的尾部静脉注射,扩散快,开始发光快,但发光持续时间较短。
参考文献
[1] Xuan Z, Zhao L, Li Z, Song W, Chen J, Chen J, Chen H, Song G, Jin C, Zhou M, Xie H, Zheng S, Song P. EPS8L3 promotes hepatocellular carcinoma proliferation and metastasis by modulating EGFR dimerization and internalization. Am J Cancer Res. 2020 Jan 1;10(1):60-77. PMID: 32064153; PMCID: PMC7017737.
[2] Mei Z, Zhang K, Lam AK, Huang J, Qiu F, Qiao B, Zhang Y. MUC1 as a target for CAR-T therapy in head and neck squamous cell carinoma. Cancer Med. 2020 Jan;9(2):640-652. doi: 10.1002/cam4.2733. Epub 2019 Dec 4. PMID: 31800160; PMCID: PMC6970025.
[3] Chen G, Fan XY, Zheng XP, Jin YL, Liu Y, Liu SC. Human umbilical cord-derived mesenchymal stem cells ameliorate insulin resistance via PTEN-mediated crosstalk between the PI3K/Akt and Erk/MAPKs signaling pathways in the skeletal muscles of db/db mice. Stem Cell Res Ther. 2020 Sep 16;11(1):401. doi: 10.1186/s13287-020-01865-7. PMID: 32938466; PMCID: PMC7493876.
产品信息
|
产品名称 |
货号 |
规格 |
价格(元) |
|
40901ES01/02/03/08/10 |
0.1/0.5/1/5/10 g |
1008/2556/3996/15876/31212 |
|
|
40902ES01/02/03/08 |
0.1/0.5/1/5 g |
1000/2600/3996/14898 |
|
|
40903ES01/02/03 |
0.1/0.5/1 |
708/2556/3588 |
|
|
40904ES02/03/08 |
0.5/1/5 mg |
589/1049/3899 |
|
|
40905ES02/03 |
0.5/1 mg |
789/1499 |
|
|
40906ES02/03/08 |
0.5/1/5 mg |
1329/2359/6759 |
|
|
40907ES10 |
10 vials |
6856 |
|
|
40908ES02/03 |
0.5/1 mg |
1329/2359 |
|
|
40909ES72 |
250 μg |
2359.00 |
|
|
40910ES72 |
250 μg |
2359.00 |
|
|
40911ES72 |
250 μg |
2359.00 |
|
|
40912ES02/03 |
0.5/1 mg |
1329/2359 |
|
|
40913ES50 |
50 μg |
929 |
|
|
11402ES60/80 |
100/1000次 |
536/4236 |
|
|
11401ES60/76/80 |
100/500/1000次 |
349/969/1748 |
更多产品敬请详询400-6111-88
HB210803
