RNase Viability Assay Kit (Fluorescent Labeling) RNase活性检测试剂盒(荧光标记法)
产品介绍
RNase活性检测试剂盒(荧光标记法)使用一种新型RNA底物,其一端标记有荧光报告基团分子(Fluor),另一端标记有淬灭基团。在不存在RNase时,淬灭基团的物理接近会将荧光报告基团中的荧光淬灭到极低水平。当有RNase时,RNA底物被水解,荧光报告基团和淬灭基团在溶液中的空间上发生分离,这导致Fluor在被适当波长的光激发时发出明亮的荧光,该荧光可以通过多功能酶标仪(含荧光模块)和基于滤光片或单色器的荧光计进行检测。RNase活性检测试剂盒(荧光标记法)采用底物荧光标记法,可定量或定性的检测单个样品中的RNase,从而判断样本是否有RNase污染。
产品特色
- 检测方法多样:可根据实际情况进行定性或定量检测;
- 符合法规:按照法规要求进行全面验证,可提供验证报告;
- 灵敏度高:检出限低至可测0.5pg的RNase A;
- 专属性强:特异性检测RNase含量,不受DNase干扰;
- 抗干扰强:RNA底物对高低pH和高盐背景溶液耐受能力强
应用案例
1、检测范围:
试剂盒可检测具备活性的RNase A浓度范围为:50pg - 0.5pg(100μL体系),R2≥0.98,各浓度检测值CV<15%。
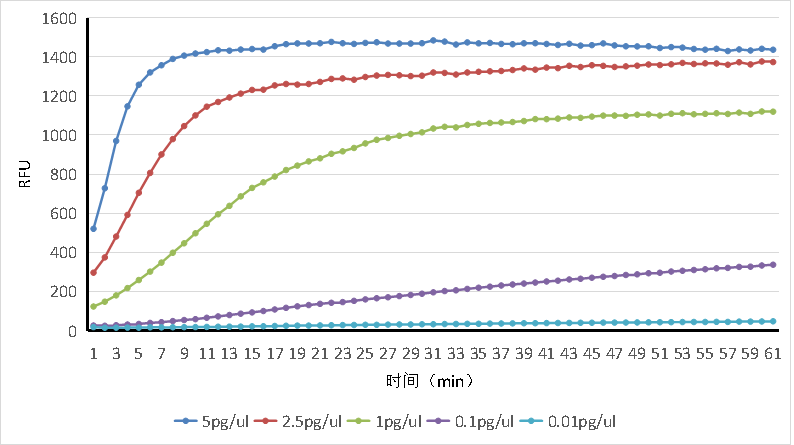
图1. RNase活性检测试剂盒动力曲线
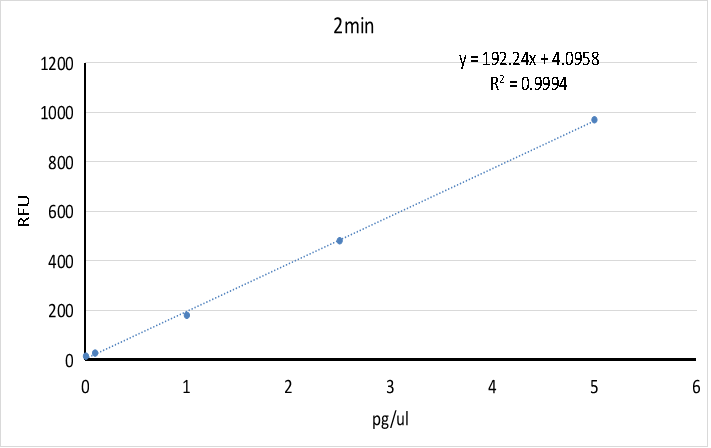
图2. RNase活性检测试剂盒2 min时的标准曲线
存储条件
1. 所有组分均干冰运输,有效期1年。
2. 收到货后,请先检查共5个组分是否齐全,再将41309-E组分2-8℃保存,其它组分-25~-15℃保存,避免反复冻融。
COA
相关产品
联系我们





