Hieff NGS® Fast-Pace DNA Cyclization Kit for MGI/单端barcode MGI环化试剂
产品介绍
Hieff NGS® Fast-Pace DNA Cyclization Kit for MGI®是针对MGI高通量测序平台专门开发设计的单链环化试剂盒。本产品采用高质量的酶和经优化后的buffer组成,显著提高反应效率,使整个环化消化流程在30 min内完成。本试剂盒适用于所有连接华大标准的单标签PCR接头文库扩增产物,除建库试剂本身的限制外,本环化试剂盒不限 MGI测序平台。
产品特色
适用于所有连接华大标准的单标签PCR接头文库扩增产物
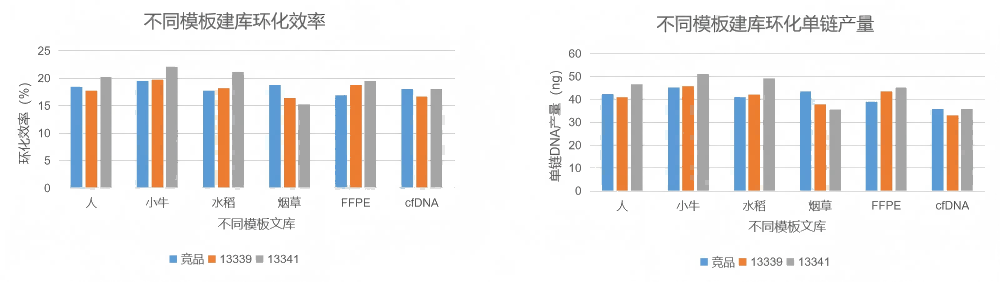
应用案例
存储条件
-25~-15℃保存,有效期1年。
COA





